FUNDAMENTOS DE LA QUÍMICA
2. MATERIA Y ENERGÍA
2.4. Estados de la materia
La materia se presenta en tres estados de agregación o estados físicos: sólido, líquido y gaseoso.
Dadas las condiciones existentes en la superficie terrestre, sólo algunas sustancias pueden hallarse de modo natural en los tres estados. Tal es el caso del agua que, como vimos anteriormente cuando analizamos los niveles macroscópicos y microscópicos de la materia, es líquida a temperaturas moderadas, sólida a temperaturas más bajas y gaseosa como vapor cuando hierve a temperaturas mayores. El resto de las sustancias se encuentra en un estado concreto sólido, líquido o gaseoso, aunque algunas pueden pasar de un estado a otro como veremos más adelante.
Cada estado de la materia tiene un conjunto de propiedades físicas que lo caracteriza, las cuales se resumen en el siguiente esquema:
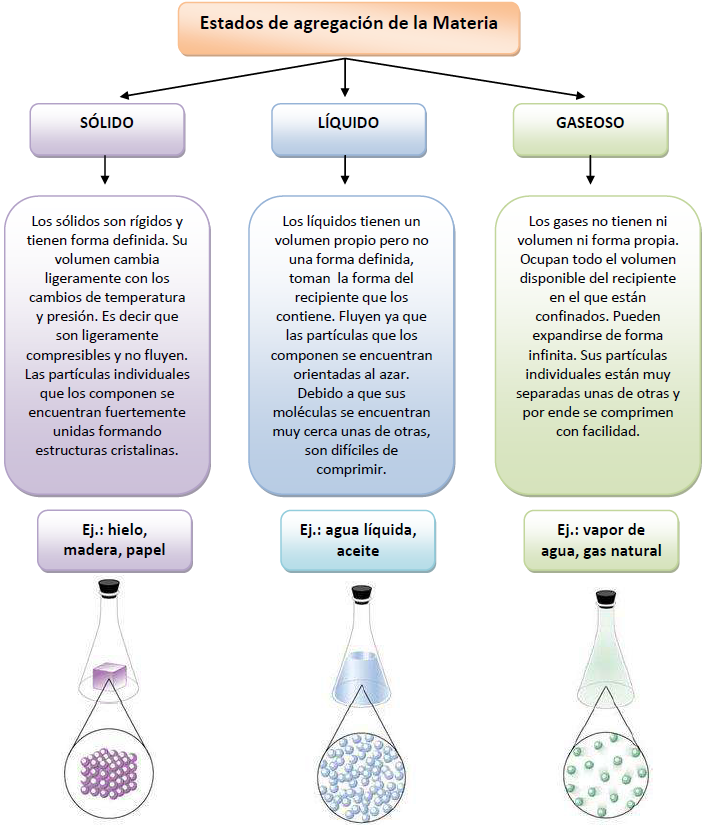
Cabanne, D., Fernández, A. (2014). Estados de agregación de la materia. [Imagen]. Cuadernillo de Nivelación en Química. Facultad de Ciencias Forestales. UNaM.
Estos estados (sólido, líquido o gaseoso) obedecen fundamentalmente a la energía cinética o energía de movimiento de las moléculas que conforman dicha materia y a la forma de agregación de las mismas. Tal vez esto nos parezca un poco complejo de entender, pero a no preocuparse que lo iremos entendiendo mejor a medida que avancemos en las lecturas. Por el momento es suficiente que comprendamos que los diferentes estados de la materia se adquieren en función de la energía de las moléculas, y que están influenciadas por la temperatura y presión del conjunto. El concepto de molécula lo veremos en las próximas semanas, pero estas ideas que estuvimos viendo hasta acá se pueden comprender con la siguiente figura, que es una representación microscópica de los tres estados de la materia: un sólido, un líquido y un gas.
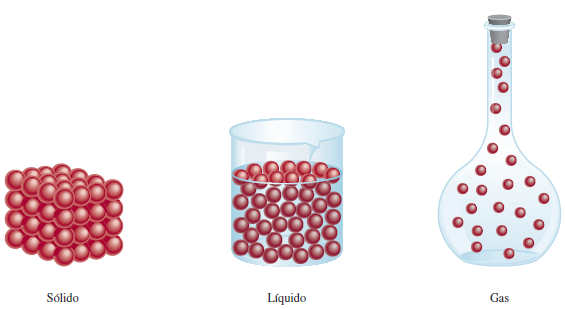
Chang, R., (2010), Química, México, The McGraw-Hill Companies, Inc. [Imagen]. Representación microscópica de un sólido, un líquido y un gas.
Como se muestra en la figura de arriba, los gases difieren de los líquidos y sólidos en la distancia que existe entre las partículas individuales que los conforman. En un sólido, las partículas se mantienen juntas de manera ordenada, con escasa libertad de movimiento. En un líquido, las partículas están cerca unas de otras, sin que se mantengan en una posición rígida, por lo que pueden moverse. En un gas, las partículas están separadas entre sí por distancias grandes en comparación con el tamaño de las propias partículas que conforman el gas, y por lo tanto pueden moverse libremente por todo el espacio del recipiente que lo contiene.
La siguiente figura resume los conceptos hasta aquí descriptos.
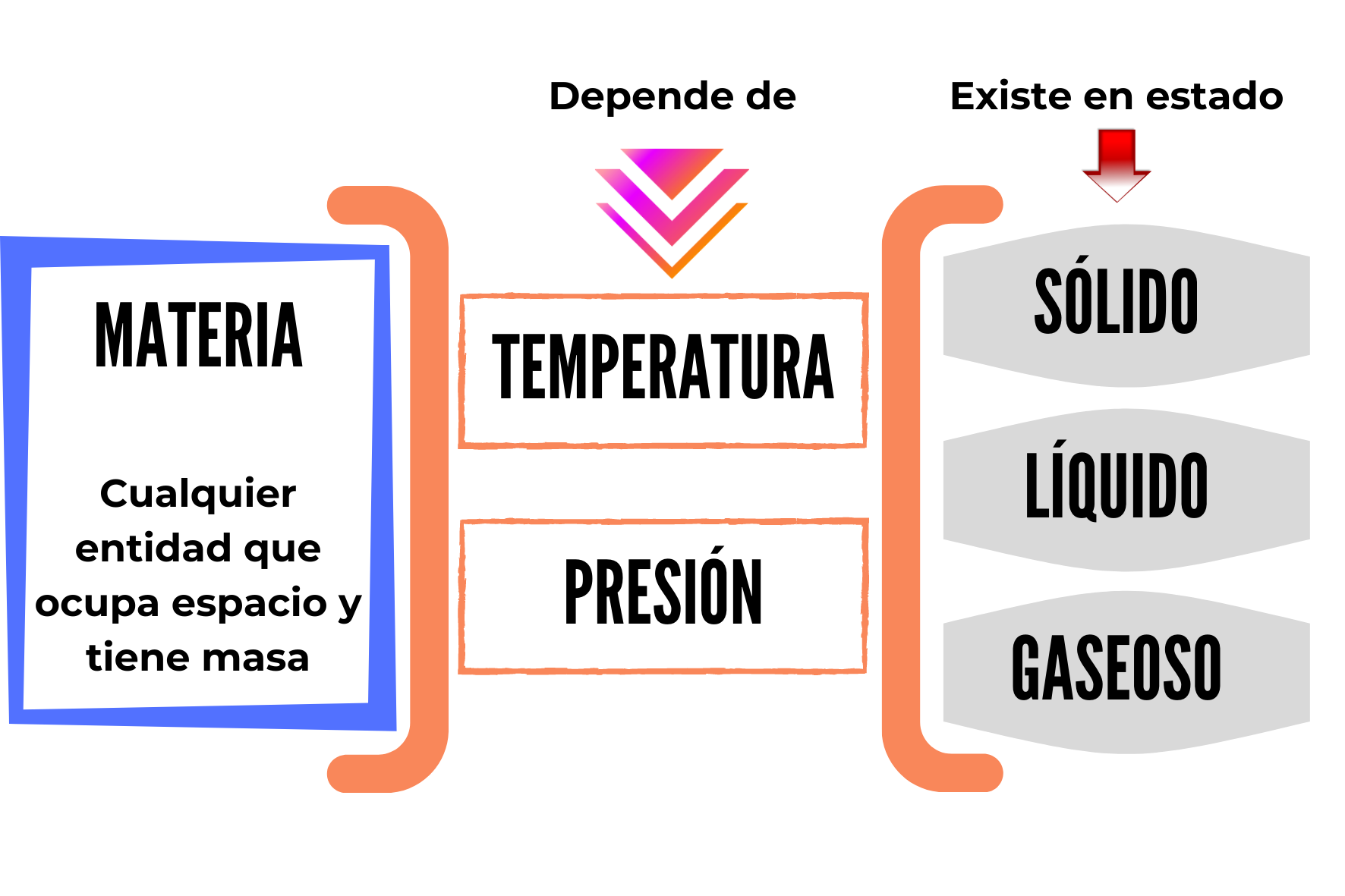
Ramos, S. (2021). Materia y estados. [Imagen]. Canva. Disponible en https://www.canva.com/design/DAEk9vx0nQE/w8hYEpLQtCqMuEcLc09b8w/view?utm_content=DAEk9vx0nQE&utm_campaign=designshare&utm_medium=link&utm_source=sharebutton
A continuación veremos cómo la materia puede pasar de un estado de agregación a otro.
