FUNDAMENTOS DE LA QUÍMICA
| Sitio: | Educación a Distancia - UNaM |
| Curso: | Química |
| Libro: | FUNDAMENTOS DE LA QUÍMICA |
| Imprimido por: | Cuenta visitante |
| Día: | viernes, 6 de febrero de 2026, 00:58 |
1. INTRODUCCIÓN

 Iniciamos el recorrido de este maravillo mundo de la química:
Iniciamos el recorrido de este maravillo mundo de la química:
Muchas personas consideran a la química demasiado abstracta y complicada. Seguramente nos suenan conocidas frases como: "La química es demasiado difícil", "nunca entendí nada de química", "debés ser muy inteligente para saber química"... Lo cierto es que todos, de alguna manera, practicamos química en nuestra vida.
¿Cocinamos, limpiamos, comemos, estamos leyendo este texto e interactuando con todo lo que nos rodea? Entonces estamos haciendo química. Las interacciones con el mundo material hacen que nos surjan preguntas sobre los materiales que nos rodean y eso es química... ¿Qué composición y estructura tienen los materiales que nos rodean? ¿Cómo interactúan con nosotros y con el entorno? ¿Cómo cambian? ¿Por qué y cuándo lo hacen? ¿Cuáles son los cambios de la materia esenciales para la vida diaria? La química nos ayuda a responder éstas y muchas preguntas más...
La química por su misma naturaleza es la ciencia central... porque para entender la biología, la ingeniería, la agronomía o cualquier otro campo, hay que tener un buen conocimiento de la química. Pero eso lo iremos comprendiendo mejor a medida que avancemos en las lecturas.
En este libro encontraremos las primeras aproximaciones a la química, que constituyen los conceptos básicos de la misma. Veremos qué es la química, qué lugar ocupa entre las otras ciencias (el centro, por supuesto). Haremos un breve recorrido sobre su origen y cómo fue evolucionando a través del tiempo. También veremos los elementos claves del universo que se relacionan con la química: materia y energía. Describiremos los diferentes estados de la materia, los cambios de un estado a otro y las transformaciones de energía que se producen.
En definitiva, en este libro veremos el mundo de la química que nos rodea, la química de la vida cotidiana... y comprenderemos por qué deberíamos darle tanta importancia a la química en nuestras vidas.
Te invitamos a que inicies este recorrido y que descubras que la química también puede ser divertida.
1.1. LA QUÍMICA

Estás mirando la pantalla de tu computadora o celular, tal vez estés tomando mate o comiendo algo, seguro algún sonido de fondo te acompaña, estás en un entorno con miles de cosas que te rodean: tu cuaderno de apuntes, birome, hojas, personas, animales, toda clase de objetos. Acabas de parpadear, estás respirando, tal vez una expresión de asombro o cansancio… y no es que te estemos observando, es que la química y sus procesos se manifiestan todo el tiempo, en el entorno y hasta en nuestro propio cuerpo aún sin pensarlo.
Ramos, S. (2021). Todo es química. Disponible en https://www.canva.com/design/DAEjSkhz_wg/N9GdWF1ZIhxNRlG7rsbG2Q/view?utm_content=DAEjSkhz_wg&utm_campaign=designshare&utm_medium=link&utm_source=sharebutton
1.2. La química en la vida cotidiana
Casi todo lo que hacemos y todas las cosas con las que nos encontramos durante el día tienen que ver con química.
La química está entre nosotros desde el momento en que nos levantamos y en cada una de las actividades que realizamos. La podemos encontrar en el café del desayuno, en el jabón que usamos para lavarnos las manos, en la ropa que vestimos en este momento e incluso en los elementos electrónicos que nos mantienen conectados al mundo. Hacer mate, cocinar huevos o cualquier alimento implica química. Todo esto y más involucran sustancias y procesos químicos.
Como vemos, la química tiene un papel protagónico en nuestras vidas, es parte del entorno que nos rodea y hace que nuestra vida sea más fácil y confortable.

Ramos, S. (2021). La química está en todas partes. [Imagen]. Adaptado de https://pixabay.com/es/illustrations/bordo-marco-frontera-tiza-5599248/

Te invitamos a que observes el siguiente vídeo donde descubrirás el papel que juega la química en todo lo que nos rodea. ¿Te identificas con algún personaje?
Química e Industrias. Revista online. [iquimicascom]. (2011, Agosto 5). La química en nuestras vidas (Chemistry: all about you) [Archivo de video]. Recuperado de https://www.youtube.com/watch?v=28wIL7_y_uk
Como vemos en el video los procesos químicos ocurren todos los días aunque no nos demos cuenta.
Cuando tomamos una rodaja de pan fresco y la colocamos en la tostadora, lo que estamos haciendo es cambiar la composición química del pan: el color marroncito de las tostadas es producto de una serie de cambios químicos, que surgen como resultado de reacciones químicas y que hacen al pan mucho más apetecible. El tostado se produce al reaccionar un aminoácido (proveniente de las proteínas del pan) con un carbohidrato (azúcar o almidón del pan), lo que forma compuestos que dan el típico sabor, color y aroma a la tostada. El calor deshidrata la superficie del pan y hace que se forme una cáscara seca y crocante. Puede además derretir los azúcares y el almidón del pan, adquiriendo ese color marroncito.



Rainer, Z. (2005). [Imagen]. Adaptado de https://commons.wikimedia.org/wiki/File:Toast-2.jpg#/media/File:Toast-1.jpg; https://commons.wikimedia.org/wiki/File:Toast-2.jpg; https://commons.wikimedia.org/wiki/File:Toast-2.jpg#/media/File:Toast-3.jpg
Las reacciones químicas que intervienen en estos procesos de tostado del pan se llaman reacciones de Maillard y también ocurren al tostar café, nueces o al cocinar carnes. (Golombek, D. y Schwarzbaum, P. (2012). El nuevo cocinero científico: Cuando la ciencia se mete en la cocina, Buenos Aires, Argentina 4° Ed. Siglo Veintiuno Editores Argentina).

Para conocer un poco más sobre las reacciones de Maillard te invitamos a que visites el siguiente sitio web donde encontrarás más información. (Saldaña Brizuela, E. R. (2009). Cocina científica. Reacción de Maillard. Recuperado de https://sites.google.com/site/cocina4ingenieros/ciencia-y-tecnologia/conceptos-basicos/Alimentacion/reaccion-de-maillard)

Sería bastante complejo imaginarlo, ya que como venimos viendo, la química está en todas partes. Toda la vida está basada en la química… Sin embargo, la Federación Italiana de la Industria Química ha recreado mediante un video cómo piensan que sería un día sin química. Te invitamos a que lo mires y pienses en la química de todo lo que te rodea.
Química e Industrias. Revista online. [iquimicascom]. (2011, Agosto 19). Como seria vivir sin la química? [Archivo de video]. Recuperado de https://youtu.be/DvhMHxeBv4A
El video completo lo puedes encontrar en la siguiente dirección https://youtu.be/28MxRV8WYWg (Copia y pega la dirección en tu navegador).
Pudimos ver en el video lo que ocurre con cada una de las cosas que rodean al personaje si no existiera la química. Como expresa la frase final "Renunciar a la química sería renunciar a todo".
Te invitamos a que continúes avanzando en las lecturas y descubras a continuación qué es específicamente la química como ciencia.
1.3. Qué es la química
Seguramente, en algún momento nos hemos preguntado ¿de qué está hecho todo lo que nos rodea?. La química nos puede dar la respuesta a ésta y a muchas otras preguntas. Pero entonces, ¿qué es la química que es tan poderosa?
El siguiente video nos cuenta en forma resumida de qué está hecho todo lo que nos rodea y nos introduce en el concepto de materia, que lo veremos en detalle más adelante. Te invitamos a que mires el video y descubras por qué es importante su estudio para todos nosotros que estamos recorriendo este apasionante mundo de la química.
Elesapiens Learning & Fun. [Elesapiens]. (2012, Agosto 31). Hablemos de Química Video Elesapiens. [Archivo de video]. Recuperado de https://youtu.be/KD56cFfKMBM
Entonces, ¿de dónde viene la palabra “química”? Si consultamos cualquier texto sobre la historia de esta ciencia, veremos que su etimología (significado de la palabra) no solo es incierta sino también variada.
Una de las ideas más aceptadas nos dice que la palabra proviene del griego χημία (chymía o quimia que significaría "mezcla de líquidos"). Términos como chemi, kimi, keme (que tienen un sonido muy similar a la palabra química) los podemos encontrar en varias lenguas.
 Así por ejemplo, existe la teoría de que la palabra química proviene del vocablo egipcio khemia, que significaría "tierra" o "tierra negra" y que se refiere a la tierra fértil de las adyacencias del río Nilo. De hecho, los egipcios daban a su país el nombre Kimet, que significa "el país negro", para referirse al contraste entre la arena roja de la región que los rodeaba y la fértil tierra negra del valle del Nilo.
Así por ejemplo, existe la teoría de que la palabra química proviene del vocablo egipcio khemia, que significaría "tierra" o "tierra negra" y que se refiere a la tierra fértil de las adyacencias del río Nilo. De hecho, los egipcios daban a su país el nombre Kimet, que significa "el país negro", para referirse al contraste entre la arena roja de la región que los rodeaba y la fértil tierra negra del valle del Nilo.
Al pueblo egipcio se lo reconoce por haber creado valiosos inventos como el vidrio, el pan y la cerveza. En el antiguo Egipto se iniciaron muchas tecnologías donde intervenía la química, como el tratamiento de metales, el uso de colorantes y la fabricación del predecesor del papel: el papiro. También el interés en el embalsamado y la conservación del cuerpo humano después de la muerte impulsó a un notable desarrollo de las "artes químicas".
Fotografoloco1. (2007). Amanecer en el Río Nilo. [Imagen]. Recuperado de https://www.flickr.com/photos/fotografoloco1/2093141224/in/photostream/
Otra explicación del origen de la palabra química, y que tiene bastante aceptación, es que deriva de la palabra griega khumos, que significa "jugo de una planta". Así, la química sería el "arte de extraer jugos". Interesante ¿no te parece?
Te invitamos a que avances en las lecturas que continúan para que descubras un poco más de la historia de la química.
1.4. La química y su historia
Ahora que sabemos que el centro de la química como ciencia es la materia podemos entender por qué a lo largo de los tiempos las personas han tratado de convertir la materia en formas más útiles. Esta no es una clase de historia pero es interesante poder ver en términos generales cómo la química estuvo desde los primeros tiempos acompañando al hombre.
Los intentos por comprender el comportamiento de la materia y sus transformaciones se remontan a más de 2500 años. En la Edad de Piedra, el hombre convertía trozos de piedra en elementos de caza, madera en estatuas, etc. Cambiaba la forma de una sustancia sin cambiar la sustancia en sí.
En el siglo VI antes de Cristo, se desarrolló en Grecia un movimiento filosófico-cultural que deseaba conocer cómo estaba constituida la materia y postulaba cuatro elementos como los constituyentes básicos: tierra, aire, fuego y agua.
A medida que el hombre fue adquiriendo más conocimientos comenzó a cambiar la composición de las sustancias: convirtió la arcilla en cerámica, las pieles en prendas de vestir, el cobre en herramientas, el grano de trigo en pan.
Existe gran consenso en que los inicios de la química fueron a través de otra disciplina conocida como alquimia. Los alquimistas egipcios fueron unos de los primeros en experimentar con el cambio y la trasmutación de la materia aunque desde una concepción mística, tal como la alquimia proponía. Esta disciplina, que combinaba elementos de química, metalurgia, medicina, astrología, espiritualismo y arte, hoy en día es considerada pseudocientífica o mágica, pero habría sido la que dio origen a la ciencia de la química.
Fueron los alquimistas quienes difundieron una fusión de tecnologías químicas y especulaciones filosóficas e intentaron transformar "metales básicos" como el plomo en "metales nobles" como el oro, crearon fermentos mágicos para curar enfermedades y conceder la vida eterna. Aunque la alquimia hizo algunas contribuciones útiles sobre cómo manipular la materia, no era científica desde los estándares modernos. En la siguiente figura vemos una obra de arte donde se muestra el taller de un alquimista.

William, P. (1775). The Alchymist. [Pintura]. Museo de Arte en Cleveland. Recuperado de https://www.clevelandart.org/art/1995.2
De la alquimia vinieron las progresiones históricas que llevaron a la química moderna: el aislamiento de las drogas de las fuentes naturales, la metalurgia y la industria de las tinturas. El hombre aprendió a separar componentes específicos de la materia, a aislar componentes de plantas con fines médicos como el aloe, la mirra y el opio, a extraer tinturas como el índigo y el púrpura tirio para pintar telas y comenzó a combinar metales para formar aleaciones (mezclas de varios elementos) como por ejemplo el bronce (mezcla de cobre y estaño). Con técnicas más elaboradas fabricó acero, una aleación de hierro y carbono que puede incluir otros elementos que le dan ciertas propiedades particulares, y que lo convierten actualmente en uno de los materiales más utilizados en el mundo.
Hoy en día, la química continúa profundizando nuestra comprensión y mejorando nuestra capacidad para aprovechar y controlar el comportamiento de la materia.

Para indagar y conocer un poco más sobre la historia de la química, te compartimos este artículo donde encontrarás una breve reseña sobre algunos procesos químicos claves a lo largo de la historia. (Sosa P., (2015). El largo y sinuoso camino de la Química. Educación Química. 26 (4), 263-266)
También te invitamos a hacer un recorrido por la historia de la química a través de la siguiente infografía. Se trata de una línea de tiempo, explicada de manera gráfica, para que reconozcas los hitos más relevantes de la química. (Elesapiens Learning & Fun. (2021). Historia de la Química. [Infografía]. Recuperado de https://www.elesapiens.com/recurso/273/historia-de-la-quimica)
Y pensar que aún quedan muchas cuestiones por resolver en la historia de la química... Afortunadamente para eso podemos estudiarla.
1.5. La química como ciencia central
Se considera a la química como la "ciencia central" debido a las interconexiones que presenta con otras disciplinas. La química y su lenguaje desempeñan un papel fundamental en biología, bioquímica, medicina, agricultura y muchos otros campos. Como ciencia básica la química se apoya en principios de física, matemáticas y fisicoquímica, y sirve a la vez como fundamento para otras ciencias como ambientales, de alimentos, nucleares y materiales, entre otras.
El conocimiento de la química es muy importante para comprender una amplia gama de disciplinas científicas. En el siguiente diagrama podemos ver algunas de las tantas interrelaciones que se establecen entre la química y otros campos.
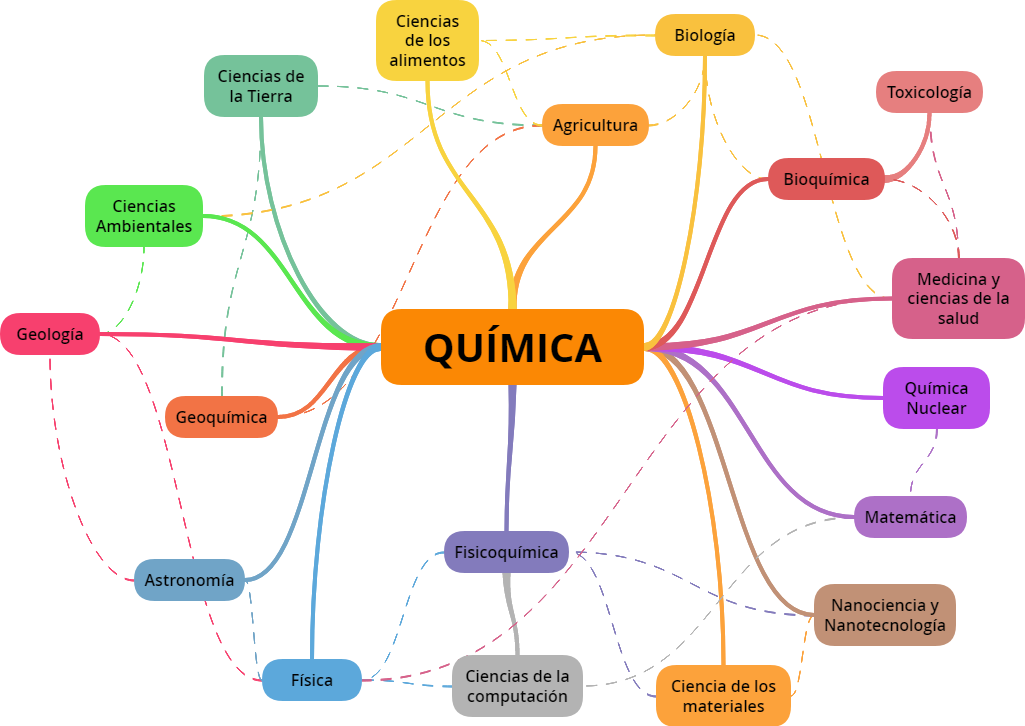
Ramos, S. (2021). Relación de la química con otras disciplinas. [Imagen]. GoConqr. Disponible en https://www.goconqr.com/es-ES/mindmap/32122677/Relaci-n-de-la-qu-mica-con-otras-disciplinas
La química está en el centro de muchas cuestiones que nos interesan: los productos farmacéuticos que fortalecen nuestra salud y prologan la vida, el desarrollo de nanomateriales de tecnología avanzada aplicados en campos como medicina y energía, la conservación de los recursos naturales y la satisfacción de nuestras necesidades diarias (alimento, vestido y vivienda). La fabricación de ladrillos, vidrios, cerámicas, pinturas y gran variedad de materiales que nos brindan confort y diseño en nuestros hogares tienen como centro a la química.
Con la ayuda de la química hemos mejorado la producción de alimentos, desarrollado fertilizantes, conservantes, saborizantes y colorantes. Hemos creado plásticos, aleaciones metálicas, nuevos materiales como paneles solares, sensores y gran variedad de productos que usamos a diario.
De esta forma nos damos cuenta por qué la química es considerada como ciencia central, ya que al ser tan práctica tiene una enorme influencia sobre otras ciencias y además es la base para el desarrollo de muchas tecnologías con las que contamos actualmente.
Sin embargo, la química también es el centro de muchas cuestiones preocupantes tales como la contaminación ambiental, la remediación y/o mitigación en los desastres ecológicos, la protección del ambiente y la satisfacción necesidades diarias en cuanto a alimentos sanos y agua limpia. Todos estos retos son posibles de resolver con la "química verde" o "química sostenible", que es una nueva y revolucionaria forma de enfocar la síntesis de sustancias químicas y que tiene como objetivo hacer una química más amigable con la salud y el medio ambiente.
Mediante la química verde podemos diseñar productos y procesos químicos en los que el uso o la generación de sustancias peligrosas se reduzcan o incluso se eliminen, desarrollando alternativas que minimicen el impacto en la vida de todos.
A continuación te compartimos los doce principios de la química verde, establecidos por Paul Anastas y Jhon Warner en los años 90. ¿Considerás que aplicas algunos de estos principios en tu vida diaria?

Ramos, S. (2021). Principios de la química verde. [Imagen]. Canvas. Disponible en https://www.canva.com/design/DAElVul9yks/8GV0sJRfbesurfcCpC7pYg/view?utm_content=DAElVul9yks&utm_campaign=designshare&utm_medium=link&utm_source=sharebutton
Y si hablamos de la aplicación de la química verde, te compartimos una nota realizada a unos docentes e investigadores de Rosario que trabajan en esta línea dando clases y ejecutando proyectos para el desarrollo de nuevos productos de alto valor agregado a partir de desechos como materia prima, la fabricación de catalizadores (sustancias químicas que modifican el desarrollo de una reacción sin consumirse en este proceso), la elaboración de compuestos con actividad biológica, entre otras cosas. La nota completa se encuentra disponible acá

García, G. J. (2018). Argentina Investiga. Divulgación Científica y Noticias Universitarias. Universidad Nacional de Rosario, Facultad de Ciencias Bioquímicas y Farmacéuticas. Recuperado de http://argentinainvestiga.edu.ar/noticia.php?titulo=quimica_verde_un_nuevo_enfoque_para_ejercerla&id=3140
Afortunadamente hoy en día estamos tomando mayor conciencia de que los recursos naturales no son eternos. Por eso se están usando los conocimientos químicos como alternativa para favorecer los procesos de reciclado de materiales, la producción de sustancias inocuas sin la generación de desechos y la remediación química, fundamentalmente para no depredar la naturaleza, ahorrar energía y preservar nuestro ambiente.
2. MATERIA Y ENERGÍA
Cuando entramos a una habitación, cuando encendemos una luz, podemos ver muchas cosas que nos rodean. Tal vez una mesa, una silla, la propia luz que ilumina el lugar. Todo lo que estamos viendo es materia y energía. Antes se pensaba que eran independientes, pero hoy sabemos que están relacionadas y por eso lo estudiaremos acá.
En esta sección nos detendremos a ver dos elementos esenciales del universo: la materia y la energía. Analizaremos los diferentes estados de la materia y qué ocurre cuando se pasa de uno a otro estado. También veremos algunos conceptos de energía y descubriremos cómo los intercambios energéticos están relacionados con los procesos químicos.
2.1. Qué es la materia
Como vimos anteriormente, el objeto de estudio de la química es la materia.
La materia comprende todo lo tangible, desde nuestro cuerpo y los materiales que nos rodean hasta los grandes objetos del universo. La materia incluye lo que podemos ver y tocar (como el agua, la tierra y los árboles) y lo que no podemos ver ni tocar (como el aire, que tiene masa y ocupa un lugar en el espacio).

 A veces resulta complicado entender que aquello que no podemos ver ni tocar también está hecho de materia. Una forma de demostrarlo es tomando nuestro ejemplo del aire. Si inflamos un globo con aire comprimido, antes de agregarle aire el globo estaba vacío y sin forma. Cuando lo inflamos, el globo se expande y por ende sabemos que ahora está lleno del aire que está ocupando el espacio. También podemos notar que el aire tiene masa, ya que al inflar el globo se hunde porque el aire comprimido es más pesado que su entorno.
A veces resulta complicado entender que aquello que no podemos ver ni tocar también está hecho de materia. Una forma de demostrarlo es tomando nuestro ejemplo del aire. Si inflamos un globo con aire comprimido, antes de agregarle aire el globo estaba vacío y sin forma. Cuando lo inflamos, el globo se expande y por ende sabemos que ahora está lleno del aire que está ocupando el espacio. También podemos notar que el aire tiene masa, ya que al inflar el globo se hunde porque el aire comprimido es más pesado que su entorno.
PublicDomainPictures. (2010). 17902 Images. [Imagen]. Recuperado de https://pixabay.com/images/id-20060/
The Confetti Party. Globo 11" sólido Rojo (desinflado). [Imagen]. Recuperado de https://theconfettiparty.com/products/globo-11-solido-rojo
A continuación veremos cómo podemos estudiar y describir a la materia desde el punto de vista macroscópico y microscópico.
2.2. Dimensiones macroscópicas y microscópicas de la materia
La materia puede ser estudiada desde un punto de vista macroscópico y otro microscópico.
Una forma práctica de entender los niveles macroscópicos y microscópicos de la materia es a través del agua. Sabemos que el agua es un líquido a temperaturas moderadas, se congelará para formar un sólido a temperaturas más bajas y hervirá para formar un gas a temperaturas más altas. Estas son observaciones macroscópicas. Pero algunas propiedades del agua corresponden al dominio microscópico, por lo que no se puede observar a simple vista. Por ejemplo, cuando decimos que una molécula de agua está formada por dos átomos de hidrógeno y un átomo de oxígeno, nos estamos refiriendo al ámbito microscópico. También la explicación de la congelación y la ebullición en términos de atracciones entre moléculas corresponde al nivel microscópico.
La siguiente figura nos ayudará a comprender mejor los niveles macroscópicos y microscópicos de la materia.
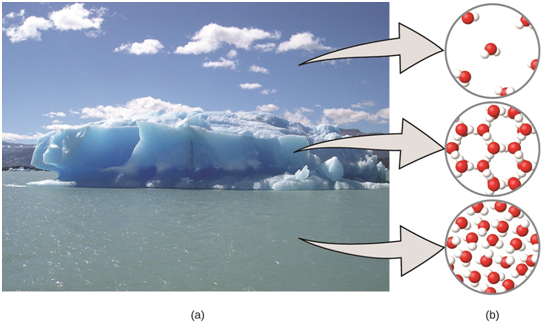
Como podemos observar en la figura representada como (a), la humedad en el aire, los icebergs y el océano representan agua en el nivel macroscópico; en tanto que en la parte (b) de la figura podemos ver cómo a nivel microscópico las moléculas de gas están muy separadas y desorganizadas, las moléculas de agua sólida están muy juntas y organizadas, y las moléculas de líquido están muy juntas y desorganizadas. Estas representaciones de (b) constituyen modelos que intentan representar cómo es la materia a nivel microscópico.
Imagen recuperada de https://espanol.libretexts.org/Quimica/Libro%3A_Quimica_General_(OpenSTAX)/01%3A_Esencia_de_la_Quimica/1.1%3A_La_quimica_en_contexto
2.3. Masa y peso
Ahora que sabemos qué es la materia, es importante definir masa y peso. Muchas veces estos términos se suelen confundir o hablar en forma indistinta entre uno y otro, pero no son lo mismo. La masa no debe confundirse con el peso de un objeto.
Una forma de medir la masa de un cuerpo es medir la fuerza que se necesita para acelerar el cuerpo. Por ejemplo, se necesita mucha más fuerza para acelerar un camión que una bicicleta porque el camión tiene mucha más masa. Otra forma más común de determinar la masa de un cuerpo es utilizando una balanza, que usa el concepto de equilibrio para comparar esa masa, en principio desconocida, con una masa estándar.

Por ejemplo, la balanza de platillos que se encuentra en muchos laboratorios de química consta de una barra que tiene los platillos y en el punto medio se encuentra una aguja. El objeto o cuerpo, cuya masa se quiere determinar, se coloca en uno de los platillos y se van agregando pesas de masa conocida en el otro platillo hasta que la aguja indica que la balanza está equilibrada. Esto nos permite conocer la masa del objeto que colocamos en el platillo.
Perez, L. (2011). Balanza. [Imagen]. Recuperado de https://www.flickr.com/photos/19362321@N04/5367540832/
Aunque el peso está relacionado con la masa, no es lo mismo.
El peso de un cuerpo cambia a medida que cambia la fuerza de la gravedad, pero su masa no.

Así por ejemplo, la masa de un astronauta no cambia sólo porque va a la Luna, pero su peso sí cambia. El peso del astronauta en la Luna es sólo una sexta parte de su peso en la Tierra, porque la gravedad de La luna es sólo una sexta parte de la gravedad de la Tierra.
OpenClipart-Vectors. (2013). Caminatas espaciales. [Imagen]. Recuperado de https://pixabay.com/images/id-153581/
2.4. Estados de la materia
La materia se presenta en tres estados de agregación o estados físicos: sólido, líquido y gaseoso.
Dadas las condiciones existentes en la superficie terrestre, sólo algunas sustancias pueden hallarse de modo natural en los tres estados. Tal es el caso del agua que, como vimos anteriormente cuando analizamos los niveles macroscópicos y microscópicos de la materia, es líquida a temperaturas moderadas, sólida a temperaturas más bajas y gaseosa como vapor cuando hierve a temperaturas mayores. El resto de las sustancias se encuentra en un estado concreto sólido, líquido o gaseoso, aunque algunas pueden pasar de un estado a otro como veremos más adelante.
Cada estado de la materia tiene un conjunto de propiedades físicas que lo caracteriza, las cuales se resumen en el siguiente esquema:
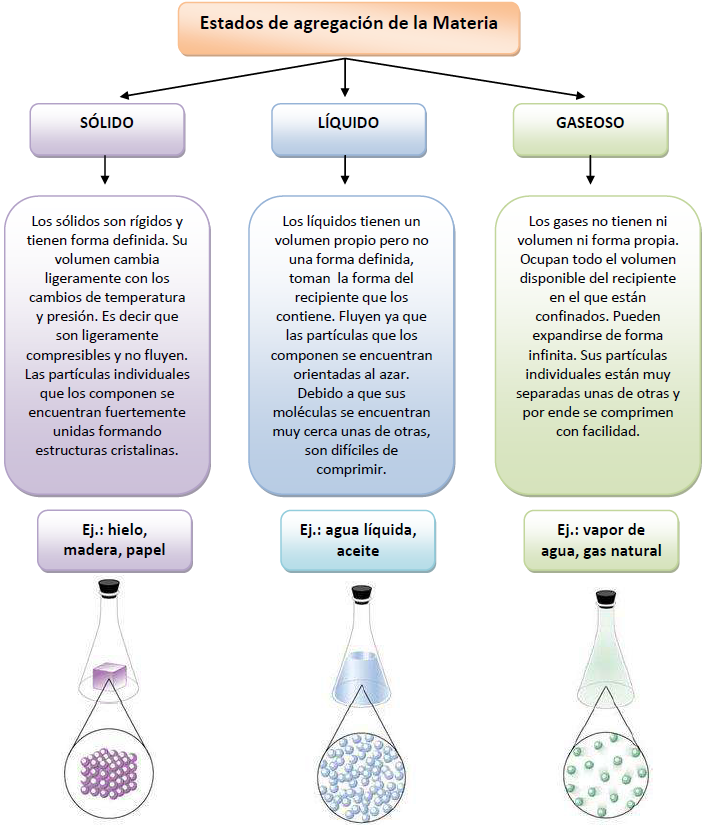
Cabanne, D., Fernández, A. (2014). Estados de agregación de la materia. [Imagen]. Cuadernillo de Nivelación en Química. Facultad de Ciencias Forestales. UNaM.
Estos estados (sólido, líquido o gaseoso) obedecen fundamentalmente a la energía cinética o energía de movimiento de las moléculas que conforman dicha materia y a la forma de agregación de las mismas. Tal vez esto nos parezca un poco complejo de entender, pero a no preocuparse que lo iremos entendiendo mejor a medida que avancemos en las lecturas. Por el momento es suficiente que comprendamos que los diferentes estados de la materia se adquieren en función de la energía de las moléculas, y que están influenciadas por la temperatura y presión del conjunto. El concepto de molécula lo veremos en las próximas semanas, pero estas ideas que estuvimos viendo hasta acá se pueden comprender con la siguiente figura, que es una representación microscópica de los tres estados de la materia: un sólido, un líquido y un gas.
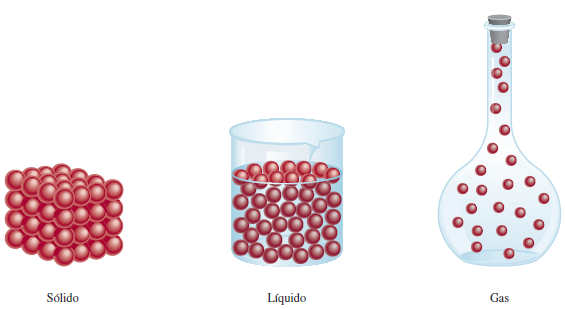
Chang, R., (2010), Química, México, The McGraw-Hill Companies, Inc. [Imagen]. Representación microscópica de un sólido, un líquido y un gas.
Como se muestra en la figura de arriba, los gases difieren de los líquidos y sólidos en la distancia que existe entre las partículas individuales que los conforman. En un sólido, las partículas se mantienen juntas de manera ordenada, con escasa libertad de movimiento. En un líquido, las partículas están cerca unas de otras, sin que se mantengan en una posición rígida, por lo que pueden moverse. En un gas, las partículas están separadas entre sí por distancias grandes en comparación con el tamaño de las propias partículas que conforman el gas, y por lo tanto pueden moverse libremente por todo el espacio del recipiente que lo contiene.
La siguiente figura resume los conceptos hasta aquí descriptos.
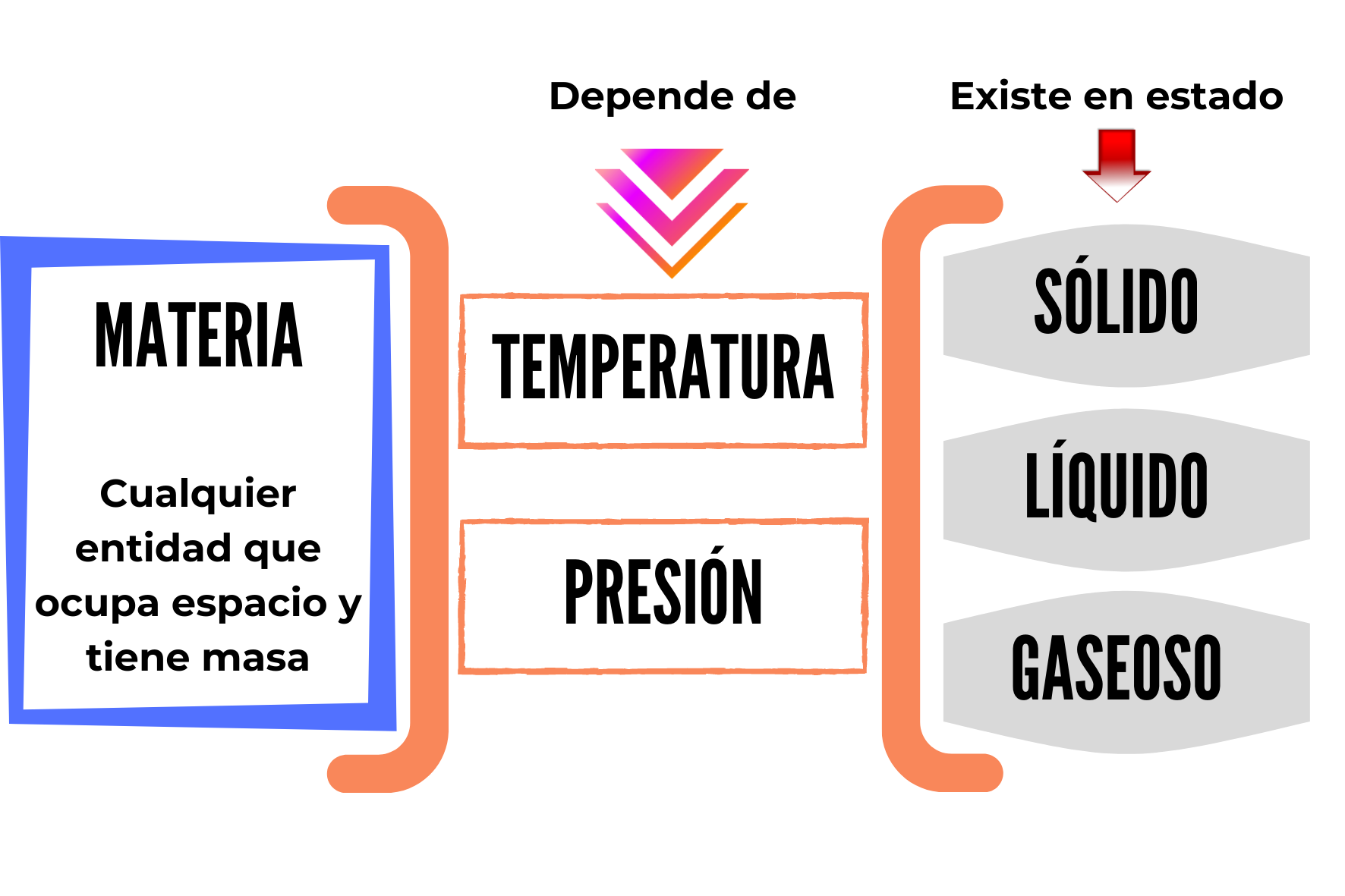
Ramos, S. (2021). Materia y estados. [Imagen]. Canva. Disponible en https://www.canva.com/design/DAEk9vx0nQE/w8hYEpLQtCqMuEcLc09b8w/view?utm_content=DAEk9vx0nQE&utm_campaign=designshare&utm_medium=link&utm_source=sharebutton
A continuación veremos cómo la materia puede pasar de un estado de agregación a otro.
2.5. Cambios de estado
Como vimos anteriormente, cada uno de los estados de agregación tiene características definidas y, dependiendo de las condiciones externas como la presión y la temperatura, una misma sustancia puede pasar de un estado de agregación a otro.
Los cambios de estado de agregación de la materia ocurren todo el tiempo en la naturaleza. Por ejemplo, cuando un témpano se funde en el océano, el hielo (estado inicial del sistema) es agua en estado sólido. Al fundirse, se convierte en agua líquida (estado final). No ha habido cambio de composición: es agua al principio y al final del proceso, pero sí cambió su estado de agregación, de sólido a líquido.
Son posibles las conversiones entre los tres estados de la materia sin que cambie la composición de la sustancia.
Noliv, M. (2021). [Archivo de video]. Recuperado de https://www.pexels.com/es-es/video/resfriado-iceberg-nieve-invierno-8318615/
Si analizamos qué pasa con el témpano cuando se desprende y se derrite en el océano vemos que se ha producido un cambio de estado de sólido a líquido. Este cambio tiene una característica particular y es que mientras coexisten ambos estados, durante el cambio de estado, la temperatura permanece constante.
Si ahora nos imaginamos que estamos calentando un sólido (por ejemplo el hielo), este se funde y se transforma en líquido (agua). La temperatura en la que ocurre esta transición se denomina punto de fusión.

El punto de fusión del hielo es 0 °C a 1 atmósfera de presión. Si observamos con un termómetro la temperatura del hielo a medida que se funde, veremos que se mantiene estable en 0 °C hasta que se derrite todo el hielo. Tal como lo dijimos previamente, durante este cambio de estado, la temperatura permanece constante.
Tenor (2016). Glaçon GIF. [Archivo GIF]. Recuperado de https://tenor.com/yAJh.gif
Si ahora calentamos el agua líquida, la temperatura comienza nuevamente a subir hasta que alcanza el siguiente cambio de estado. El calentamiento convierte el líquido en gas y esta conversión ocurre en el punto de ebullición del líquido.
Para el caso del agua líquida que pasa a agua gaseosa o vapor de agua, la temperatura de ebullición es de 100 °C a 1 atmósfera de presión. Nuevamente, mientras se produce el cambio de estado de líquido al gaseoso la temperatura de ebullición no variará mientras haya líquido sin evaporar.

Murprotec España. (2018). Humedad por condensación. [Imagen]. Recuperado de https://www.flickr.com/photos/72282342@N08/49104698897/in/photostream/
Por otra parte, el enfriamiento de un gas hace que se condense en la forma de líquido. Este fenómeno es el que ocurre por ejemplo en los vidrios que se empañan en invierno.
Al enfriar adicionalmente un líquido, se congela a su forma sólida. Así por ejemplo el agua se congela cuando la temperatura desciende por debajo de los 0 °C y pasa a convertirse en un sólido (hielo).
Hay determinados materiales que pueden pasar directamente del estado al sólido al gaseoso a través del fenómeno de sublimación. Un ejemplo es el caso de la naftalina que se suele usar como antipolillas para ropas. La naftalina sublima a temperatura ambiente y por eso podemos sentir ese típico olor en el ambiente o impregnado en la ropa. En el siguiente video podemos ver el fenómeno de sublimación de la naftalina.
Paredes, S. (2010, enero 31). Sublimación de la naftalina. [Archivo de video]. Recuperado de https://youtu.be/bJrKn2TlIiQ
En el video observamos cómo la naftalina, que se encuentra inicialmente en estado sólido, comienza a pasar al estado gaseoso. La sublimación se evidencia por la formación de burbujas que se desprenden del sólido y ascienden en el líquido en el cual está sumergida. (Aclaración: la naftalina está sumergida en el líquido solamente para que podamos apreciar el proceso de sublimación, que de no ser así sería difícil de percibir a través de un video).
Ahora vamos a analizar el pasaje directo del estado gaseoso a sólido. Tal es el caso de los vapores de iodo que cuando se los hace chocar contra una superficie a muy baja temperatura pasan del estado gaseoso al sólido.
En el siguiente video podemos observar inicialmente el proceso de sublimación del iodo, un elemento de la tabla periódica que a temperatura ambiente se encuentra en estado sólido, y que al calentarlo pasa al estado gaseoso (sublimación). Luego, cuando los vapores de iodo chocan contra una superficie fría, ocurre la sublimación regresiva: los vapores de iodo se vuelven a convertir nuevamente en iodo sólido. Interesante ¿no te parece?
Lineros, M. (2012, enero 6). Sublimación y sublimación inversa del yodo. [Archivo de video]. Recuperado de https://youtu.be/astGYlMps04
2.6. Energía
Cuando la materia experimenta un cambio físico, como los que acabamos de mencionar, cambiará su estado, pero su identidad o composición seguirá siendo la misma. Así por ejemplo, la forma sólida del agua, como la nieve o el hielo, tienen una apariencia distinta a la de su forma líquida o gaseosa, pero las tres formas siguen siendo la misma sustancia: agua.
Anteriormente, cuando vimos los estados de la materia, introducimos la idea de que estos estados sólido, líquido y gaseoso eran función de la energía cinética o energía de movimiento de las moléculas y ahora comprenderemos por qué esto es así.
Para que una sustancia pase de un estado a otro es necesario que exista un intercambio de energía con el medio o alrededores. Este intercambio, por lo general en forma de calor, puede darse en dos sentidos: en uno, la sustancia recibe calor del medio, y en otro, la sustancia entrega calor al medio. Conforme la sustancia absorbe energía del medio, aumenta la energía cinética de las partículas. Cuando hablamos de energía cinética nos estamos refiriendo a la energía que posee la materia en virtud de su movimiento.
Cuando la sustancia absorbe energía del medio, el proceso es endotérmico. En cambio, si durante el cambio de estado se libera energía al medio, el proceso es exotérmico.
La palabra "endotérmica" deriva del griego endon que significa "dentro" y therme que significa "calor". Por eso una reacción química es endotérmica cuando absorbe energía del entorno. En este caso, la energía en forma de calor se transfiere del exterior al interior del sistema. Cuando colocamos un termómetro mientras se produce la reacción endotérmica, la temperatura disminuye.

Por ejemplo, imaginemos una compresa de agua fría que usamos para tratar distensiones musculares. Cuando las sustancias que componen la compresa (agua y una sal como nitrato de amonio, que la estudiaremos más adelante) se juntan, provocan una sensación de frío. Se trata de un proceso endotérmico en el cual se producen una absorción de energía del medio, y la característica de este tipo de reacciones es que se siente frío.
Greelane. Lo que necesita saber sobre el nitrato de amonio. [Imagen]. Recuperado de https://www.greelane.com/es/ciencia-tecnolog%c3%ada-matem%c3%a1ticas/ciencia/how-to-make-ammonium-nitrate-608267/
Por otro lado, la palabra "exotérmica" se forma por exo que significa "hacia afuera" y thermes, que significa "calor". Por eso una reacción es exotérmica cuando la energía fluye hacia afuera del sistema. En este caso la energía se libera en forma de calor, por lo que al colocar un termómetro mientras se produce la reacción, la temperatura aumenta. Las reacciones exotérmicas pueden presentarse de forma espontánea y, en algunos casos llegar a ser explosivas, como la combinación de ciertos metales y agua.
Otro ejemplo de un proceso exotérmico es la reacción de combustión que se produce cuando se usa un soplete de oxiacetileno. Este proceso también libera energía en forma de luz como lo indica la llama del soplete de la figura.
Danahé, S. J. (2015). Soldadura oxiacetilénica. [Imagen]. Recuperado de https://0grados.com.mx/soldadura-oxiacetilenica/
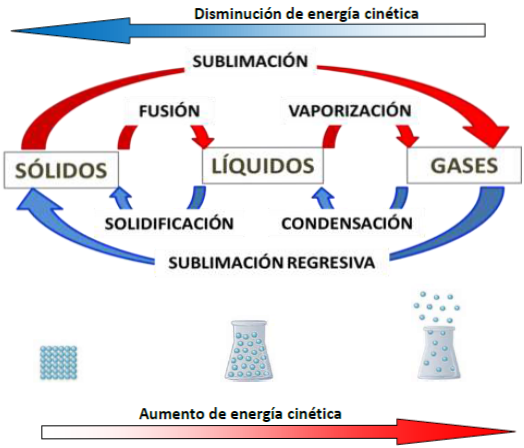
En la siguiente representación se muestran los cambios de estado del agua y su relación con la energía cinética. En azul se muestran los cambios exotérmicos y en rojo los endotérmicos. La energía cinética de las partículas aumenta conforme la sustancia absorbe energía del medio y disminuye a medida que la sustancia libera energía al medio.
Cabanne, D., Fernández, A. (2014). Cambios de estado. [Imagen]. Cuadernillo de Nivelación en Química. Facultad de Ciencias Forestales. UNaM.
Si analizamos qué ocurre desde el punto de vista de la energía de las moléculas en los diferentes estados de la materia podemos decir que:
En el pasaje de sólido a líquido (fusión), el sólido absorbe calor y se produce un aumento de movilidad molecular. Por ejemplo, en los sólidos cristalinos como el hielo, las partículas que los forman se encuentran en posiciones fijas, como si fuera un patrón ordenado. Al absorber calor esta arquitectura molecular del sólido se desmorona haciendo que cada molécula se desplace una sobre otra pasando al estado líquido.
En el pasaje de líquido a gaseoso (vaporización), al cederle calor al líquido, aumenta su energía cinética y de esta forma se adquiere una gran movilidad molecular, que permite el pasaje del líquido al estado gaseoso.
En el pasaje de gaseoso a líquido (condensación), cuando el gas encuentra un medio más frío, con menor temperatura, cede calor, disminuye su energía cinética, se estrechan los espacios entre moléculas y de esta forma el gas pasa al estado líquido.
En el pasaje de líquido a sólido (solidificación), las moléculas del líquido que se desplazan unas sobre otras dejan de hacerlo cuando pierden calor y bajan su temperatura, disminuyendo la energía cinética a tal punto que las moléculas quedan moviéndose en su lugar y de esta manera pasan al estado sólido.
En el pasaje de sólido a gaseoso (sublimación), las moléculas al absorber calor de una fuente energética o simplemente del medio ambiente, adquieren suficiente energía cinética (movimiento) para pasar directamente al estado gaseoso.
En el pasaje de gaseoso a sólido (sublimación regresiva), ocurre una disminución importante de la temperatura que hace que las moléculas muy móviles de un gas pasen abruptamente a quedar con muy poca movilidad, moviéndose prácticamente en su lugar y pasando así al estado sólido.
Tanto el aprovechamiento de la energía liberada en algunas reacciones (exotérmicas) como el proceso inverso en el que se necesita un aporte de energía para que se produzca la reacción (endotérmica), ponen de manifiesto la importancia que tienen los intercambios energéticos en los procesos químicos y en los cambios de estado.
ACTIVIDADES PRÁCTICAS

Ahora que terminaste de leer este libro, te invitamos a que realices un cuestionario que también encontrarás en la pestaña Actividades. Ahí podrás poner en práctica todos los conceptos desarrollados hasta acá y te servirá como ejercicio y preparación para la evaluación integradora final. ¡Adelante, vamos a practicar! Haz CLIC AQUÍ.
3. REFERENCIAS
Bibliografía
Anastas, P. T.; Warner, J. C.,(1998). Green Chemistry: Theory and Practice, New York, Oxford University Press.
Butcher, S., Charlson, R. (1972). An Introduction to Air Chemistry. New York. Academic Press.
Chang, R. (2010). Química, México, The McGraw-Hill Companies, Inc.
Coelho, F. (2021). Diccionario de dudas. Etimología de química. Recuperado de https://www.diccionariodedudas.com/etimologia-de-quimica/
Doria Serrano, M. C. (2009). Química Verde: un nuevo enfoque para el cuidado del medio ambiente. Educación Química, 20 (4), 412-420. Recuperado de http://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S0187-893X2009000400004&lng=es&tlng=es.
Elesapiens Learning & Fun (2021). Historia de la Química. [Infografía]. Recuperado de https://www.elesapiens.com/contenidos-educativos/info-recurso/273/historia-de-la-quimica
García, G. J. (2018). Argentina Investiga. Divulgación Científica y Noticias Universitarias. Universidad Nacional de Rosario, Facultad de Ciencias Bioquímicas y Farmacéuticas. Recuperado de http://argentinainvestiga.edu.ar/noticia.php?titulo=quimica_verde_un_nuevo_enfoque_para_ejercerla&id=3140
Golombek, D., Schwarzbaum, P. (2012). El nuevo cocinero científico: Cuando la ciencia se mete en la cocina, Buenos Aires, Argentina 4° Ed. Siglo Veintiuno Editores Argentina.
Pájaro Castro, N. P, Olivero Verbel, J. T (2011). Química Verde: un nuevo reto. Ciencia e Ingeniería Neogranadina. 21 (2), 169-182. https://doi.org/10.18359/rcin.265
Rodríguez, L. (2011). Pura química. El origen de la palabra "Química". Recuperado de https://blogdequimica4.blogspot.com/2011/03/el-origen-de-la-palabra-quimica.html
Saldaña Brizuela, E. R. (2009). Cocina científica. Reacción de Maillard. Recuperado de https://sites.google.com/site/cocina4ingenieros/ciencia-y-tecnologia/conceptos-basicos/Alimentacion/reaccion-de-maillard
Sosa P., (2015). El largo y sinuoso camino de la Química. Educación Química. 26 (4), 263-266.
Imágenes
Cabanne, D., Fernández, A. (2014). Cambios de estado. [Imagen]. Cuadernillo de Nivelación en Química. Facultad de Ciencias Forestales. UNaM.
Cabanne, D., Fernández, A. (2014). Estados de agregación de la materia. [Imagen]. Cuadernillo de Nivelación en Química. Facultad de Ciencias Forestales. UNaM.
Chang, R. (2010). Representación microscópica de un sólido, un líquido y un gas. [Imagen]. The McGraw-Hill Companies, Inc.
Danahé, S. J. (2015). Soldadura oxiacetilénica. [Imagen]. Recuperado de https://0grados.com.mx/soldadura-oxiacetilenica/
Fotografoloco1. (2007). Amanecer en el Río Nilo. [Imagen]. Recuperado de https://www.flickr.com/photos/fotografoloco1/2093141224/in/photostream/
Greelane. (s. f.). Lo que necesita saber sobre el nitrato de amonio. [Imagen]. Recuperado de https://www.greelane.com/es/ciencia-tecnolog%c3%ada-matem%c3%a1ticas/ciencia/how-to-make-ammonium-nitrate-608267/
Murprotec España. (2018). Humedad por condensación. [Imagen]. Recuperado de https://www.flickr.com/photos/72282342@N08/49104698897/in/photostream/
OpenClipart-Vectors. (2013). Caminatas espaciales. [Imagen]. Recuperado de https://pixabay.com/images/id-153581/
Perez, L. (2011). Balanza. [Imagen]. Recuperado de https://www.flickr.com/photos/19362321@N04/5367540832/
PublicDomainPictures. (2010). 17902 Images. [Imagen]. Recuperado de https://pixabay.com/images/id-20060/
Rainer, Z. (2005). [Imagen]. Adaptado de https://commons.wikimedia.org/wiki/File:Toast-2.jpg#/media/File:Toast-1.jpg; https://commons.wikimedia.org/wiki/File:Toast-2.jpg; https://commons.wikimedia.org/wiki/File:Toast-2.jpg#/media/File:Toast-3.jpg
Ramos, S. (2021). La química está en todas partes. [Imagen]. Adaptado de https://pixabay.com/es/illustrations/bordo-marco-frontera-tiza-5599248/
Ramos, S. (2021). Materia y estados. [Imagen]. Canva. Disponible en https://www.canva.com/design/DAEk9vx0nQE/w8hYEpLQtCqMuEcLc09b8w/view?utm_content=DAEk9vx0nQE&utm_campaign=designshare&utm_medium=link&utm_source=sharebutton
Ramos, S. (2021). Principios de la química verde. [Imagen]. Canva. Disponible en https://www.canva.com/design/DAElVul9yks/8GV0sJRfbesurfcCpC7pYg/view?utm_content=DAElVul9yks&utm_campaign=designshare&utm_medium=link&utm_source=sharebutton
Ramos, S. (2021). Relación de la química con otras disciplinas. [Imagen]. GoConqr. Disponible en https://www.goconqr.com/es-ES/mindmap/32122677/Relaci-n-de-la-qu-mica-con-otras-disciplinas
Ramos, S. (2021). Todo es química. [Imagen]. Canva. Disponible en https://www.canva.com/design/DAEjSkhz_wg/N9GdWF1ZIhxNRlG7rsbG2Q/view?utm_content=DAEjSkhz_wg&utm_campaign=designshare&utm_medium=link&utm_source=sharebutton
Tenor (2016). Glaçon GIF. [Archivo GIF]. Recuperado de 
The Confetti Party. Globo 11" sólido Rojo (desinflado). [Imagen]. Recuperado de https://theconfettiparty.com/products/globo-11-solido-rojo
William, P. (1775). The Alchymist. [Pintura]. Museo de Arte en Cleveland. Recuperado de https://www.clevelandart.org/art/1995.2
Videos
Elesapiens Learning & Fun. [Elesapiens]. (2012, Agosto 31). Hablemos de Química Video Elesapiens. [Archivo de video]. Recuperado de https://youtu.be/KD56cFfKMBM
Federación Italiana de la Industria Química. [Federchimica]. (2007, Septiembre 25). Federchimica: video "vivere senza chimica?". [Archivo de video]. Recuperado de https://youtu.be/28MxRV8WYWg
Lineros, M. (2012, enero 6). Sublimación y sublimación inversa del yodo. [Archivo de video]. Recuperado de https://youtu.be/astGYlMps04
Noliv, M. (2021). [Archivo de video]. Recuperado de https://www.pexels.com/es-es/video/resfriado-iceberg-nieve-invierno-8318615/
Paredes, S. (2010, enero 31). Sublimación de la naftalina. [Archivo de video]. Recuperado de https://youtu.be/bJrKn2TlIiQ
Química e Industrias. Revista online. [iquimicascom]. (2011, Agosto 19). Como seria vivir sin la química?. [Archivo de video]. Recuperado de https://youtu.be/DvhMHxeBv4A
Química e Industrias. Revista online. [iquimicascom]. (2011, Agosto 5). La química en nuestras vidas (Chemistry: all about you). [Archivo de video]. Recuperado de https://www.youtube.com/watch?v=28wIL7_y_uk
