FORMULACIÓN Y NOMENCLATURA DE COMPUESTOS INORGÁNICOS PARTE II

Imagen extraída de: https://concepto.de/compuesto-quimico/
3. SALES NEUTRAS
3.2. Oxosales
Las oxosales son compuestos ternarios que se forman por la combinación de un oxoácido y un hidróxido, que origina como subproducto agua.
Se obtienen mediante la siguiente ecuación general:
Oxoácido + Hidróxido -----> Oxosal + H2O
Fórmula Química: Queda determinada por el catión (proveniente del hidróxido) ubicado a la izquierda y el anión (proveniente del oxoácido, que consta del no metal y el oxígeno) ubicado a la derecha: las cargas del catión y del anión se intercambian y se escriben como subíndices, para lograr la electroneutralidad de la sal formada.
Ejemplo:
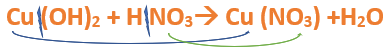
Nomenclatura: Según la nomenclatura tradicional: ➡️ El primer nombre proviene del anión producido a partir del oxoácido, siendo reemplazados los sufijos de la siguiente manera: ⏺️ “oso” -> “ito”; ejemplo: nitroso (del oxoácido) -> nitrito (en la sal) ⏺️ “ico” -> “ato”; ejemplo; nítrico (del oxoácido) -> nitrato (en la sal) ➡️ El segundo nombre proviene del catión obtenido a partir del hidróxido, cuyo nombre no cambia. Ejemplos: ⏺️ Nitrato ferroso Fe (NO3)2; el nitrógeno trabaja con el mayor número de oxidación (+V) y el hierro con el menor (+II) ⏺️ Nitrato férrico Fe (NO3)3; el nitrógeno trabaja con el mayor número de oxidación (+V) y el hierro también (+III). ➡️ Si el metal que forma el hidróxido posee sólo una valencia, el compuesto se nombra utilizando el nombre dado por el anión y se utiliza la palabra “…de” y el elemento metálico. Por ejemplo: Nitrato de plata. Ahora te proponemos que leas con atención el siguiente tutorial paso a paso para formular una Oxosal. En este tutorial plantearemos la ecuación de formación de una oxosal, con el objetivo de obtener su fórmula, usando como referencia el nombre que obtiene por nomenclatura tradicional. Vamos paso a paso: Paso 1: En primer lugar, debemos conocer el nombre del compuesto y a partir del mismo, y junto a las reglas de nomenclatura poder extraer la información necesaria: Paso 2: En cálculos auxiliares formamos el ácido nítrico (puedes ayudarte con el tutorial de formación de oxoácidos) y el hidróxido cúprico (puedes ayudarte con el tutorial de formación de hidróxidos), en este caso no balancearemos las ecuaciones, ya que solo nos interesan las fórmulas: Calculo Auxiliar: En la tabla periódica buscamos los números de oxidación del metal y el no metal: Dato: el N tiene varios números de oxidación, pero los más habituales para formar oxoácidos y oxosales son +3 y+5. Para formar el Ácido nítrico: Teniendo en cuenta el nombre del compuesto seleccionamos el número de oxidación correspondiente al no metal. El N utilizará el +5, ya que el nombre termina en “ato” (viene de “ico”). Para formar el Hidróxido cúprico: Teniendo en cuenta el nombre del compuesto seleccionamos el número de oxidación correspondiente al metal. El Cu utiliza el +2, ya que el nombre de la sal termina en “ico”. Paso 3: Escribimos las fórmulas de los reactivos, en este caso la del hidróxido [Cu(OH)2] y del ácido (HNO3) que formulaste en el paso anterior, separados por un signo + (no importa el orden de los reactivos): Paso 4: Luego de los reactivos agregamos la flecha de reacción (-->): Paso 5: Para que se forme la sal los dos reactivos deben ionizarse (dividirse), el H del ácido se separa del (NO3)- y el Cu del hidróxido se separa de los (OH)-: Paso 6: El H+ del ácido y el OH- del hidróxido se unen y forman agua en los productos: Paso 7: para formar la sal escribimos el símbolo del metal (Cu) seguido por el símbolo del no metal y los oxígenos tal como estaban en el ácido, pero sin el hidrógeno (NO3)-: Paso 8: Cuando los reactivos se ionizan para formar la sal, forman iones. Calculamos la carga del catión y del anión aplicando las reglas para asignar números de oxidación que vimos en bloques anteriores: Una forma fácil y rápida de reconocer la carga de los iones en este paso es teniendo en cuenta la cantidad de OH- y de H+ que liberan el hidróxido y el ácido respectivamente. Por ejemplo, el Cu(OH)2 al ionizarse libera de 2 OH- y forma el ion Cu2+, mientras que el HNO3 libera 1 H+ y forma el ion NO3-. Paso 9: Escribimos la carga del Cu como subíndice del (NO3) y viceversa. De esta manera se logra la electroneutralidad de la sal.
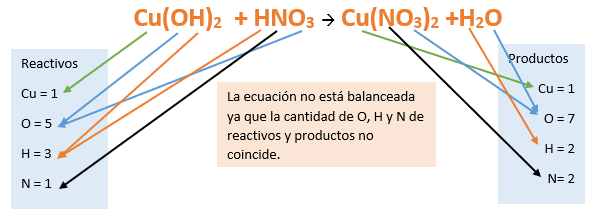
Paso 10: Revisamos si la ecuación está balanceada: Paso 11: Finalmente, si la ecuación no se encuentra balanceada, es preciso realizar esta operación. Una forma sencilla es balancear primero el metal, luego el no metal y finalmente balancear los hidrógenos agregando un coeficiente delante de la molécula de H2O. Autor: Holzmaisters Jonathan.Tutorial paso a paso 3: Formación de una oxosal a partir de su nombre

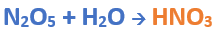
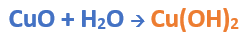
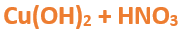
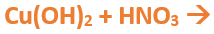
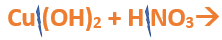

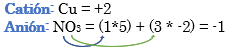

Para repasar lo que leíste, te proponemos que observes y tomes nota del siguiente video tutorial. Autor: Holzmaisters Jonathan.

Ahora te invitamos a realizar una actividad sobre formulación y nomenclatura de las oxosales. Para acceder haz CLIC AQUÍ.
