FORMULACIÓN Y NOMENCLATURA DE COMPUESTOS INORGÁNICOS PARTE II
| Sitio: | Educación a Distancia - UNaM |
| Curso: | Química |
| Libro: | FORMULACIÓN Y NOMENCLATURA DE COMPUESTOS INORGÁNICOS PARTE II |
| Imprimido por: | Cuenta visitante |
| Día: | sábado, 14 de febrero de 2026, 21:33 |
1. INTRODUCCIÓN
En este libro vas a encontrar...

 La semana pasada estuviste trabajando en torno a la formulación y nomenclatura de algunos tipos de compuestos inorgánicos - combinaciones binarias con hidrógeno y con oxígeno. En el libro de esta semana, te proponemos que continúes avanzando en el desarrollo de otro tipo de compuestos: los hidróxidos, oxoácidos y las sales neutras.
La semana pasada estuviste trabajando en torno a la formulación y nomenclatura de algunos tipos de compuestos inorgánicos - combinaciones binarias con hidrógeno y con oxígeno. En el libro de esta semana, te proponemos que continúes avanzando en el desarrollo de otro tipo de compuestos: los hidróxidos, oxoácidos y las sales neutras.
Para ello, este libro está organizado de la siguiente manera:
CAPÍTULO: COMPUESTOS TERNARIOS: HIDRÓXIDOS Y OXOÁCIDOS
-
- Hidróxidos
-
- Oxoácidos
CAPÍTULO: SALES BINARIAS
-
- Sales haloideas o hidrosales
-
- Oxosales
CAPÍTULO: RESUMEN DE COMPUESTOS INORGÁNICOS
Dentro de cada capítulo, los contenidos se presentan dentro de subcapítulos en los que podrás encontrar algunos textos de divulgación científica introductorios a los temas, el desarrollo del contenido teórico así como también ejemplos y tutoriales en forma de texto y video.
Aclaración
Como pudiste leer en el libro anterior, los compuestos inorgánicos pueden clasificarse en función al tipo de elementos involucrados en su formación (hidruros, óxidos, hidrácidos, etcétera) o a la cantidad de elementos distintos que se hallan en la fórmula química de los compuestos (binarios, ternarios, cuaternarios, etcétera). Si se tiene presente esta última clasificación, podrás identificar que, dentro de los compuestos binarios se hallan los hidruros, los hidrácidos, los óxidos y, como verás ahora, las hidrosales. Mientras que los hidróxidos, los oxoácidos y las oxosales se encuentran en el grupo de los compuestos ternarios. Sin embargo, con fines prácticos, en este libro se opta por la combinación entre ambas maneras de clasificar a los compuestos.2. COMPUESTOS TERNARIOS: HIDRÓXIDOS Y OXOÁCIDOS
En este capítulo se desarrollarán dos tipos de compuestos ternarios, los hidróxidos y los oxoácidos. Como pudiste leer en la introducción, las oxosales también son compuestos ternarios, sin embargo, nos abocaremos a ellas en el siguiente capítulo.
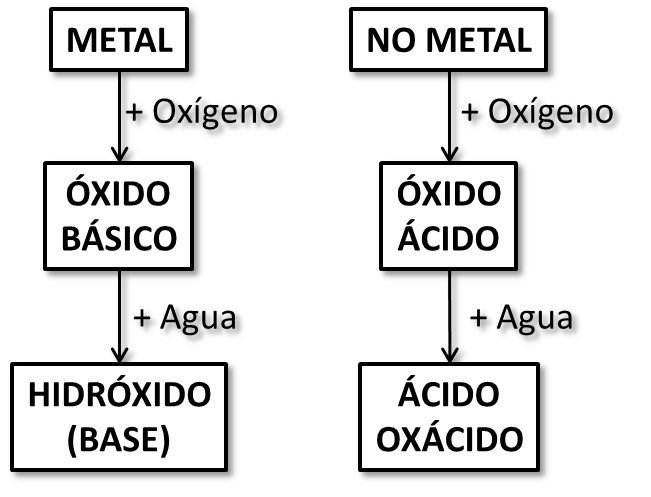
En líneas generales, puede decirse que los hidróxidos se forman por la combinación de los óxidos básicos con agua y que los oxoácidos lo hacen por la combinación entre un óxido ácido o anhídrido con agua. En las siguientes páginas veremos los detalles como ecuación de formación, fórmula química y nomenclatura.
En algunas bibliografías, encontrarás que es común referirse a los hidróxidos como "bases" y a los oxoácidos e hidrácidos como "ácidos". Esto se debe a que, si se tiene presente la escala de pH, que va de 0 a 14, donde el 7 representa un pH neutro, los valores mayor a 7 implican un pH básico y los menores, un pH ácido: los hidróxidos, en general, poseen un pH alto (mayor a 7), por lo que se dice que tienen un carácter básico mientas que los oxoácidos e hidrácidos poseen un pH bajo (menor a 7), por lo que presentan carácter ácido. Los detalles de a qué se debe que posean este carácter exceden a los objetivos de este libro.
*Imagen extraída de: Khan Academy: Funciones Químicas Inorgánicas. Consultado en: https://es.khanacademy.org/science/quimica-pe-pre-u/xa105e22a677145a0:enlaces-quimicos/xa105e22a677145a0:funciones-quimicas-inorganicas/a/352-funciones-qumicas-inorgnicas
2.1. Hidróxidos
Los hidróxidos son compuestos que se producen por la combinación de un óxido básico con H2O. Se obtienen de acuerdo con la siguiente ecuación general:
Óxido Básico + H2O --> Hidróxido
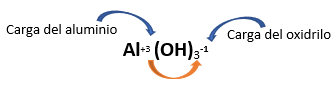
Ejemplo: Al2O3 + H2O --> Al(OH)3
Fórmula Química: La fórmula general de un hidróxido es M(OH)n, donde M es el símbolo químico del metal y n se corresponde con su número de oxidación.
Por ejemplo:
Estos compuestos también son conocidos como “bases”.
Nomenclatura: Los hidróxidos se nombran con la palabra hidróxido seguida de la preposición “de” y el nombre del metal, si este tiene 1 valencia. Ejemplo: Hidróxido de Aluminio
Si el metal tiene dos valencias, conserva el sufijo que utilizaba en el óxido básico.
➡️ “oso” cuando el elemento usa la menor valencia; Ejemplo: Fe(OH)2, valencia del hierro (II): Hidróxido ferroso.
➡️ “ico” cuando el elemento va con la mayor valencia; Ejemplo: Fe(OH)3, valencia del hierro (III): Hidróxido férrico.
Ahora te proponemos que leas con atención el siguiente tutorial paso a paso para formular un Hidróxido.
Tutorial paso a paso 1: Formación de un hidróxido a partir de su nombre
En este tutorial plantearemos la ecuación de formación de un hidróxido, con el objetivo de obtener su fórmula, usando como referencia el nombre que obtiene por nomenclatura tradicional. Vamos paso a paso: Paso 1: En primer lugar, debemos conocer el nombre del compuesto y a partir del mismo, y junto a las reglas de nomenclatura, poder extraer la información necesaria: Paso 2: En cálculos auxiliares formamos el óxido férrico (puedes ayudarte con el tutorial de formación de óxidos básicos), en este caso no balancearemos la ecuación, ya que solo nos interesa la formula del óxido: Calculo Auxiliar: En la tabla periódica buscamos las valencias o número de oxidación del metal: Teniendo en cuenta el nombre del compuesto seleccionamos el número de oxidación correspondiente para cada elemento: El Fe utiliza el +3, ya que el nombre del compuesto termina en "ico", indicando que el hierro trabaja con la mayor valencia. Luego planteamos la ecuación de formación del óxido correspondiente: Paso 3: Escribimos las fórmulas de los reactivos, en este caso el óxido férrico que formulaste en el paso anterior (Fe2O3) y agua (H2O), separados por un signo + (no importa el orden de los reactivos, puede escribirse el Fe2O3 o el H2O primero y luego el otro): Paso 4: Luego de los reactivos agregamos la flecha de reacción (-->): Paso 5: Empezamos a platear la formula del hidróxido, para ello escribimos después de la flecha de reacción, el símbolo del metal (Fe) seguido del grupo oxidrilo entre paréntesis, después de la flecha de reacción: Paso 6: Escribimos el número de oxidación del Fe como subíndice del grupo oxidrilo: Paso 7: Revisamos si la ecuación está balanceada: Paso 8: Finalmente, si la ecuación no se encuentra balanceada, es preciso realizar esta operación. Para ello es necesario agregar coeficientes estequiométricos. En este caso se debe agregar un 2 delante del Fe(OH)3 en productos para que coincida la cantidad de hierro y luego se debe agregar un 3 frente al H2O en reactivos para que la cantidad de oxígeno e hidrógeno coincida: Y de esta manera obtenemos la ecuación balanceada del Hidróxido Férrico. Autor: Holzmaisters Jonathan.
Para repasar lo que leíste, te proponemos que observes y tomes nota del siguiente video tutorial. Autor: Holzmaisters Jonathan.

Ahora te proponemos que realices una breve actividad sobre formulación de hidróxidos. Para acceder haz CLIC AQUÍ.
2.2. Oxoácidos
En el libro anterior pudiste leer sobre un tipo de ácidos, los hidrácidos. En este apartado te invitamos a aprender sobre otro tipo de ácidos, los Oxoácidos. El prefijo “oxo” se utiliza para indicar que este compuesto posee Oxígeno en su estructura química, elemento que no se hallaba en los ácidos estudiados en el libro anterior.
Los oxoácidos son compuestos ternarios de hidrógeno, oxígeno y un elemento electronegativo, generalmente no metálico (también puede ser un elemento de transición con número de oxidación elevado), que se obtienen de la combinación de un anhídrido con agua mediante la siguiente ecuación general:
Anhídrido + H2O --> Oxoácido
Ejemplo: N2O3 + H2O -------> 2HNO2
Fórmula Química: La fórmula general de los oxoácidos es HaNbOc, siendo N un elemento electronegativo (no metálico, en la mayoría de los casos). El subíndice que acompaña a cada uno de estos elementos está determinado por el número de átomos que hay de cada uno de ellos en el lado de los reactivos, si son múltiplos se simplifican.
Ejemplo: 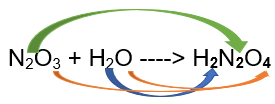 ➡️
➡️ 
Nomenclatura:
Según la nomenclatura tradicional:
➡️ Si el no metal con el que se combina tiene dos valencias se utilizan los sufijos “oso” e “ico” y se suprime la sílaba “de”:
⏺️“oso” cuando el elemento usa la menor valencia; Ejemplo: HNO2, valencia del nitrógeno (III): Ácido nitroso
⏺️“ico” cuando el elemento va con la mayor valencia; Ejemplo: HNO3, valencia del nitrógeno (V): Ácido nítrico.
Ahora te proponemos que leas con atención el siguiente tutorial paso a paso para formular un Oxoácido.
Tutorial paso a paso 2: Formación de un oxoácido a partir de su nombre
En este tutorial plantearemos la ecuación de formación de un oxoácido, con el objetivo de obtener su fórmula, usando como referencia el nombre que obtiene por nomenclatura tradicional. Vamos paso a paso: Paso 1: En primer lugar, debemos conocer el nombre del compuesto y a partir del mismo, y junto a las reglas de nomenclatura poder extraer la información necesaria: Paso 2: En cálculos auxiliares formamos el anhídrido bromoso (puedes ayudarte con el tutorial de formación de anhídridos), en este caso no balancearemos la ecuación, ya que solo nos interesa la formula del anhídrido: Calculo Auxiliar: En la tabla periódica buscamos los números de oxidación de cada elemento: Teniendo en cuenta el nombre del compuesto seleccionamos el número de oxidación o valencia correspondiente para cada elemento: El O utilizará el -2 ya que se trata de un óxido, y el Br el +3, ya que el nombre termina en “oso”. Paso 3: Escribimos las fórmulas de los reactivos, en este caso el anhídrido que formulaste en el paso anterior (Br2O3) y agua (H2O), separados por un signo + (no importa el orden de los reactivos, puede escribirse el Br2O3 o el H2O primero y luego el otro): Paso 4: Luego de los reactivos agregamos la flecha de reacción (-->): Paso 5: Empezamos a platear la fórmula del oxoácido, para ello después de la flecha de reacción escribimos el símbolo de cada elemento en el siguiente orden: hidrógeno, no metal (Br) y oxígeno (sin separarlos con +): Paso 6: Contamos la cantidad de átomos de cada elemento en Reactivos, luego escribimos estos valores como subíndices en cada uno de los elementos del producto. Como en reactivos hay 2 de átomos de hidrógeno (presentes en el agua) en el hidrógeno del producto agregamos un subíndice 2. En reactivos hay 2 átomos de bromo (presentes en el anhídrido) entonces agregamos un subíndice 2 en el bromo del producto. Al tener 4 átomos de oxígeno en reactivos (3 en el anhídrido + 1 en el agua) escribimos un subíndice 4 en el oxígeno del producto. Importante: siempre que, en un compuesto todos los subíndices sean múltiplos entre sí, es necesario simplificarlos, para obtener la formula correcta. En este caso debemos dividir todos los subíndices por 2, quedando la fórmula de la siguiente manera: Paso 7: Revisamos si la ecuación está balanceada: Paso 8: Finalmente, si la ecuación no se encuentra balanceada, debemos realizar esta operación mediante el uso de coeficientes estequiométricos. En este caso se debe agregar un 2 delante del HBrO2 en productos para que la cantidad de hidrógeno, bromo y oxígeno coincida: Y de esta manera obtenemos la ecuación balanceada del Ácido Bromoso. Autor: Holzmaisters Jonathan.
Para repasar lo que leíste, te proponemos que observes y tomes nota del siguiente video tutorial. Autor: Holzmaisters Jonathan.

Ahora te invitamos a realizar una actividad de formulación y nomenclatura de oxoácidos. Para acceder haz CLIC AQUÍ.
3. SALES NEUTRAS
Las sales son compuestos que se forman por la reacción de un hidróxido con un ácido, que da como productos una sal y agua. Las sales pueden ser neutras, ácidas o básicas. En este libro sólo se abordan las sales neutras, es decir, aquellas en las que todos los hidrógenos del ácido son reemplazadas por iones metálicos provenientes del hidróxido.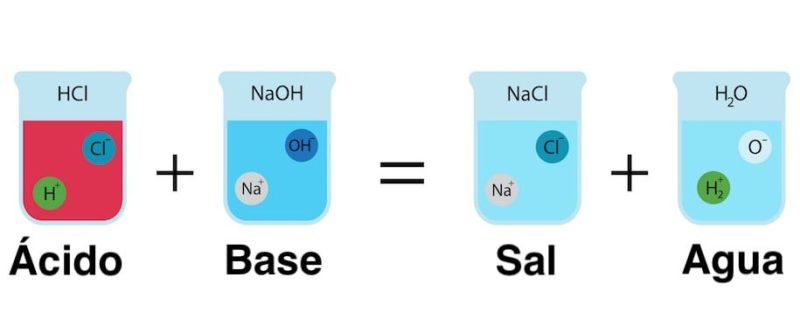 Las sales inorgánicas son compuestos iónicos porque están formadas por iones unidos por medio de enlaces químicos. Dicha unión les confiere a las sales ciertas propiedades: la capacidad de formar cristales, conducir la corriente eléctrica cuando están disueltas, la propiedad de solubilidad, entre otras. Los iones involucrados provienen del hidróxido y del ácido que reaccionan.
Las sales inorgánicas son compuestos iónicos porque están formadas por iones unidos por medio de enlaces químicos. Dicha unión les confiere a las sales ciertas propiedades: la capacidad de formar cristales, conducir la corriente eléctrica cuando están disueltas, la propiedad de solubilidad, entre otras. Los iones involucrados provienen del hidróxido y del ácido que reaccionan.
Dentro de las sales neutras, se hallan dos tipos:
-
- Hidrosal o sal haloidea: que se forma por la reacción de un hidróxido con un hidrácido.
-
- Oxosal: que se forma por la reacción de un hidróxido con un oxoácido.
*Imagen extraída de: https://opcionesejemplo.blogspot.com/2019/12/ejemplos-de-hidroxidos-en-la-vida.html
3.1. Hidrosales
Las hidrosales son compuestos binarios, es decir, formados por átomos de dos elementos diferentes, que se forman por la reacción entre un hidróxido y un hidrácido y que origina como subproducto agua.
Se obtienen mediante la siguiente ecuación general:
Hidrácido + Hidróxido -----> Hidrosal + H2O
Fórmula Química: Queda determinada por el catión (proveniente del hidróxido) ubicado a la izquierda y el anión (proveniente del hidrácido) ubicado a la derecha.
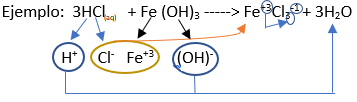
Nomenclatura:
Según la nomenclatura tradicional:
➡️ El primer nombre proviene del anión producido a partir de hidrácido, siendo reemplazado el sufijo “hídrico” por “uro”. Por ejemplo: Ácido clorhídrico --------> Cloruro…(Cl-)
➡️ El segundo nombre refiere al del catión proveniente del hidróxido, conservando su nomenclatura en función a si trabaja con la menor valencia o con la mayor: “oso”, “ico”, respectivamente; o utilizando la palabra “de” según sea el caso. Ejemplo: Cloruro férrico; FeCl3.
Ahora te proponemos que leas con atención el siguiente tutorial paso a paso para formular una sal haloidea o Hidrosal.
Tutorial paso a paso 3: Formación de una hidrosal a partir de su nombre
En este tutorial plantearemos la ecuación de formación de una hidrosal, con el objetivo de obtener su fórmula, usando como referencia el nombre que obtiene por nomenclatura tradicional. Vamos paso a paso: Paso 1: En primer lugar, debemos conocer el nombre del compuesto y a partir del mismo, y junto a las reglas de nomenclatura poder extraer la información necesaria: Importante: como existen 2 tipos de sales es necesario saber cómo diferenciarlas: Sabemos que estamos en presencia de una oxosal si la primera parte de su nombre contiene el nombre de un no metal con sufijo ATO o ITO y la segunda parte contiene el nombre de un metal (con sufijo OSO o ICO). Por ejemplo, Perclorato de calcio, Nitrato plumboso, Sulfito cúprico o Hipoclorito de sodio. Sabemos que estamos en presencia de una Hidrosal si la primera parte de su nombre termina en URO y la segunda parte del nombre contiene el nombre de un metal, terminado en OSO o ICO. Por ejemplo, Cloruro de sodio, Sulfuro ferroso o Bromuro niquélico. Paso 2: En cálculos auxiliares formamos el ácido clorhídrico (puedes ayudarte con el tutorial de formación de hidrácidos) y el hidróxido férrico (puedes ayudarte con el tutorial de formación de hidróxidos), en este caso no balancearemos las ecuaciones, ya que solo nos interesan las fórmulas: Calculo Auxiliar: En la tabla periódica buscamos las valencias o número de oxidación del metal y el no metal: Para formar el Hidróxido férrico: Teniendo en cuenta el nombre del compuesto seleccionamos el número de oxidación correspondiente al metal: El Fe utiliza el +3, ya que el nombre de la sal termina en “ico”, por lo cual el hidróxido correspondiente es el hidróxido férrico. Para formar el Ácido clorhídrico: Teniendo en cuenta el nombre del compuesto seleccionamos el número de oxidación correspondiente al no metal: El Cl utilizara el -1, ya que el nombre termina en “uro” (viene de "hídrico"), es decir, el ácido clorhídrico. Paso 3: Escribimos las fórmulas de los reactivos, en este caso el hidróxido [Fe(OH)3] y el ácido [HCl(aq)] que formaste en el paso anterior, separados por un signo + (no importa el orden de los reactivos): Paso 4: Luego de los reactivos agregamos la flecha de reacción (-->): Paso 5: Para que se forme la sal los dos reactivos deben ionizarse (dividirse), el H del ácido se separa del Cl y el Fe del hidróxido se separa de los OH-: Paso 6: El H+ del ácido y el OH- de hidróxido se unen y forman agua en los productos: Paso 7: para formar la sal escribimos el símbolo del metal (Fe) seguido por el símbolo del no metal (Cl): Al separarse de 3 OH-, se forma el ion férrico con carga +3 (Fe3+), de manera similar, al separarse del H+, el cloro forma el ion Cl- (con una carga negativa). Paso 8: Escribimos la carga del Cloro como subíndice del Hierro y viceversa para lograr la electroneutralidad: Paso 9: Revisamos si la ecuación esta balanceada: Paso 10: Finalmente, si la ecuación no se encuentra balanceada, es preciso realizar esta operación. Una forma sencilla de balancear la ecuación consiste en igualar la cantidad de H y OH- que tenemos en reactivos y luego balancear el agua. Para ello agregamos un coeficiente 3 frente al HCl (como el hidróxido tiene 3 OH- necesitamos 3 H del ácido). Como en reactivos tenemos 3 OH- y 3 H, a partir de estos se deberían formar 3 moléculas o moles de H2O, por ello agregamos un coeficiente 3 frente a este compuesto: Y de esta manera obtenemos la ecuación balanceada del Cloruro Férrico Autor: Holzmaisters Jonathan.
Para repasar lo que leíste, te proponemos que observes y tomes nota del siguiente video tutorial. Autor: Holzmaisters Jonathan.

Ahora te proponemos que realices una actividad de formulación y nomenclatura de las hidrosales. Para acceder haz CLIC AQUÍ.
3.2. Oxosales
Las oxosales son compuestos ternarios que se forman por la combinación de un oxoácido y un hidróxido, que origina como subproducto agua.
Se obtienen mediante la siguiente ecuación general:
Oxoácido + Hidróxido -----> Oxosal + H2O
Fórmula Química: Queda determinada por el catión (proveniente del hidróxido) ubicado a la izquierda y el anión (proveniente del oxoácido, que consta del no metal y el oxígeno) ubicado a la derecha: las cargas del catión y del anión se intercambian y se escriben como subíndices, para lograr la electroneutralidad de la sal formada.
Ejemplo:
Nomenclatura: Según la nomenclatura tradicional: ➡️ El primer nombre proviene del anión producido a partir del oxoácido, siendo reemplazados los sufijos de la siguiente manera: ⏺️ “oso” -> “ito”; ejemplo: nitroso (del oxoácido) -> nitrito (en la sal) ⏺️ “ico” -> “ato”; ejemplo; nítrico (del oxoácido) -> nitrato (en la sal) ➡️ El segundo nombre proviene del catión obtenido a partir del hidróxido, cuyo nombre no cambia. Ejemplos: ⏺️ Nitrato ferroso Fe (NO3)2; el nitrógeno trabaja con el mayor número de oxidación (+V) y el hierro con el menor (+II) ⏺️ Nitrato férrico Fe (NO3)3; el nitrógeno trabaja con el mayor número de oxidación (+V) y el hierro también (+III). ➡️ Si el metal que forma el hidróxido posee sólo una valencia, el compuesto se nombra utilizando el nombre dado por el anión y se utiliza la palabra “…de” y el elemento metálico. Por ejemplo: Nitrato de plata. Ahora te proponemos que leas con atención el siguiente tutorial paso a paso para formular una Oxosal.Tutorial paso a paso 3: Formación de una oxosal a partir de su nombre
En este tutorial plantearemos la ecuación de formación de una oxosal, con el objetivo de obtener su fórmula, usando como referencia el nombre que obtiene por nomenclatura tradicional.
Vamos paso a paso:
Paso 1: En primer lugar, debemos conocer el nombre del compuesto y a partir del mismo, y junto a las reglas de nomenclatura poder extraer la información necesaria:
Paso 2: En cálculos auxiliares formamos el ácido nítrico (puedes ayudarte con el tutorial de formación de oxoácidos) y el hidróxido cúprico (puedes ayudarte con el tutorial de formación de hidróxidos), en este caso no balancearemos las ecuaciones, ya que solo nos interesan las fórmulas:
Calculo Auxiliar:
En la tabla periódica buscamos los números de oxidación del metal y el no metal:
Dato: el N tiene varios números de oxidación, pero los más habituales para formar oxoácidos y oxosales son +3 y+5.
Para formar el Ácido nítrico:
Teniendo en cuenta el nombre del compuesto seleccionamos el número de oxidación correspondiente al no metal. El N utilizará el +5, ya que el nombre termina en “ato” (viene de “ico”).
Para formar el Hidróxido cúprico:
Teniendo en cuenta el nombre del compuesto seleccionamos el número de oxidación correspondiente al metal. El Cu utiliza el +2, ya que el nombre de la sal termina en “ico”.
Paso 3: Escribimos las fórmulas de los reactivos, en este caso la del hidróxido [Cu(OH)2] y del ácido (HNO3) que formulaste en el paso anterior, separados por un signo + (no importa el orden de los reactivos):
Paso 4: Luego de los reactivos agregamos la flecha de reacción (-->):
Paso 5: Para que se forme la sal los dos reactivos deben ionizarse (dividirse), el H del ácido se separa del (NO3)- y el Cu del hidróxido se separa de los (OH)-:
Paso 6: El H+ del ácido y el OH- del hidróxido se unen y forman agua en los productos:
Paso 7: para formar la sal escribimos el símbolo del metal (Cu) seguido por el símbolo del no metal y los oxígenos tal como estaban en el ácido, pero sin el hidrógeno (NO3)-:
Paso 8: Cuando los reactivos se ionizan para formar la sal, forman iones. Calculamos la carga del catión y del anión aplicando las reglas para asignar números de oxidación que vimos en bloques anteriores:
Una forma fácil y rápida de reconocer la carga de los iones en este paso es teniendo en cuenta la cantidad de OH- y de H+ que liberan el hidróxido y el ácido respectivamente. Por ejemplo, el Cu(OH)2 al ionizarse libera de 2 OH- y forma el ion Cu2+, mientras que el HNO3 libera 1 H+ y forma el ion NO3-.
Paso 9: Escribimos la carga del Cu como subíndice del (NO3) y viceversa. De esta manera se logra la electroneutralidad de la sal.
Paso 10: Revisamos si la ecuación está balanceada:
Paso 11: Finalmente, si la ecuación no se encuentra balanceada, es preciso realizar esta operación. Una forma sencilla es balancear primero el metal, luego el no metal y finalmente balancear los hidrógenos agregando un coeficiente delante de la molécula de H2O.
Y de esta manera obtenemos la ecuación balanceada del Nitrato Cúprico.
Autor: Holzmaisters Jonathan.

Para repasar lo que leíste, te proponemos que observes y tomes nota del siguiente video tutorial. Autor: Holzmaisters Jonathan.

Ahora te invitamos a realizar una actividad sobre formulación y nomenclatura de las oxosales. Para acceder haz CLIC AQUÍ.
3.3. Aplicaciones de las Sales Neutras
4. RESUMEN DE COMPUESTOS INORGÁNICOS
El siguiente esquema resume los tipos de compuestos inorgánicos desarrollados en estas dos semanas y los reactivos involucrados en su formación.
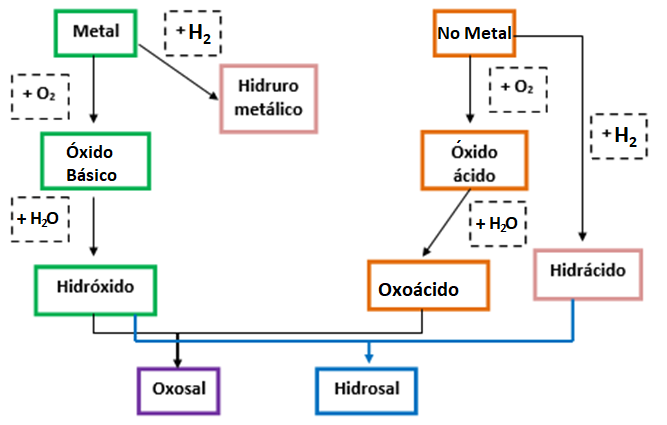
A modo de resumen se podría decir que, los metales pueden, por un lado, combinarse con H2 para dar lugar a los hidruros metálicos y por el otro, con O2 para formar óxidos básicos. Los óxidos básicos, a su vez, pueden combinarse con H2O dando lugar así a los hidróxidos.
Por otra parte, los elementos no metálicos y algunos elementos de transición (conocidos como anfóteros) pueden combinarse con O2 para formar óxidos ácidos o anhídridos. Estos, a su vez, pueden combinarse con H2O para dar formar oxoácidos. Así también, ciertos elementos no metálicos (halógenos y anfígenos) pueden combinarse con H2 para formar hidruros no metálicos, mayormente de naturaleza gaseosa, que se disuelven en agua para formar hidrácidos que se hallan en forma de solución acuosa.
Finalmente, de la reacción de un hidróxido y un hidrácido se produce una hidrosal y H2O; mientras que de la reacción entre un hidróxido y un oxoácido se obtiene una oxosal y H2O. Es importante que tengas en cuenta las reglas para asignar números de oxidación a la hora de formarlos y que recuerdes cómo varía la nomenclatura tradicional en cada caso.

Ahora que terminaste de leer este libro, te invitamos a que realices el CUESTIONARIO DEL TEMA donde encontrarás actividades relacionadas a todo lo abordado en este material. Para acceder haz CLIC AQUÍ.
5. REFERENCIAS BIBLIOGRÁFICAS
- Brown, T. L., LeMay, H. E., Bursten, B. E., & Burdge, J. R. (2004). Química. La ciencia central (9° ed.). México: Pearson Educación.
- Cabanne, Daniela; Fernández, Andrea. (2014). "Capítulo III: Formulación de compuestos inorgánicos. Nomenclatura". Cuadernillo de Nivelación en Química. Facultad de Ciencias Forestales. UNaM.
- Peterson, W. R. (2013). Nomenclatura de las sustancias químicas (3° ed.). Barcelona: Editorial Reveté S.A.
