FORMULACIÓN Y NOMENCLATURA DE COMPUESTOS INORGÁNICOS PARTE II

Imagen extraída de: https://concepto.de/compuesto-quimico/
3. SALES NEUTRAS
3.1. Hidrosales
Las hidrosales son compuestos binarios, es decir, formados por átomos de dos elementos diferentes, que se forman por la reacción entre un hidróxido y un hidrácido y que origina como subproducto agua.
Se obtienen mediante la siguiente ecuación general:
Hidrácido + Hidróxido -----> Hidrosal + H2O
Fórmula Química: Queda determinada por el catión (proveniente del hidróxido) ubicado a la izquierda y el anión (proveniente del hidrácido) ubicado a la derecha.
Nomenclatura:
Según la nomenclatura tradicional:
➡️ El primer nombre proviene del anión producido a partir de hidrácido, siendo reemplazado el sufijo “hídrico” por “uro”. Por ejemplo: Ácido clorhídrico --------> Cloruro…(Cl-)
➡️ El segundo nombre refiere al del catión proveniente del hidróxido, conservando su nomenclatura en función a si trabaja con la menor valencia o con la mayor: “oso”, “ico”, respectivamente; o utilizando la palabra “de” según sea el caso. Ejemplo: Cloruro férrico; FeCl3.
Ahora te proponemos que leas con atención el siguiente tutorial paso a paso para formular una sal haloidea o Hidrosal.
Tutorial paso a paso 3: Formación de una hidrosal a partir de su nombre
En este tutorial plantearemos la ecuación de formación de una hidrosal, con el objetivo de obtener su fórmula, usando como referencia el nombre que obtiene por nomenclatura tradicional.
Vamos paso a paso:
Paso 1: En primer lugar, debemos conocer el nombre del compuesto y a partir del mismo, y junto a las reglas de nomenclatura poder extraer la información necesaria:
Importante: como existen 2 tipos de sales es necesario saber cómo diferenciarlas:
- Sabemos que estamos en presencia de una oxosal si la primera parte de su nombre contiene el nombre de un no metal con sufijo ATO o ITO y la segunda parte contiene el nombre de un metal (con sufijo OSO o ICO). Por ejemplo, Perclorato de calcio, Nitrato plumboso, Sulfito cúprico o Hipoclorito de sodio.
- Sabemos que estamos en presencia de una Hidrosal si la primera parte de su nombre termina en URO y la segunda parte del nombre contiene el nombre de un metal, terminado en OSO o ICO. Por ejemplo, Cloruro de sodio, Sulfuro ferroso o Bromuro niquélico.
Paso 2: En cálculos auxiliares formamos el ácido clorhídrico (puedes ayudarte con el tutorial de formación de hidrácidos) y el hidróxido férrico (puedes ayudarte con el tutorial de formación de hidróxidos), en este caso no balancearemos las ecuaciones, ya que solo nos interesan las fórmulas:
Calculo Auxiliar:
En la tabla periódica buscamos las valencias o número de oxidación del metal y el no metal:

Para formar el Hidróxido férrico:
Teniendo en cuenta el nombre del compuesto seleccionamos el número de oxidación correspondiente al metal:
El Fe utiliza el +3, ya que el nombre de la sal termina en “ico”, por lo cual el hidróxido correspondiente es el hidróxido férrico.
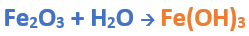
Para formar el Ácido clorhídrico:
Teniendo en cuenta el nombre del compuesto seleccionamos el número de oxidación correspondiente al no metal:
El Cl utilizara el -1, ya que el nombre termina en “uro” (viene de "hídrico"), es decir, el ácido clorhídrico.
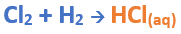
Paso 3: Escribimos las fórmulas de los reactivos, en este caso el hidróxido [Fe(OH)3] y el ácido [HCl(aq)] que formaste en el paso anterior, separados por un signo + (no importa el orden de los reactivos):
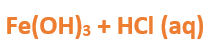
Paso 4: Luego de los reactivos agregamos la flecha de reacción (-->):

Paso 5: Para que se forme la sal los dos reactivos deben ionizarse (dividirse), el H del ácido se separa del Cl y el Fe del hidróxido se separa de los OH-:

Paso 6: El H+ del ácido y el OH- de hidróxido se unen y forman agua en los productos:

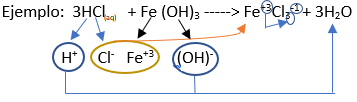
Paso 7: para formar la sal escribimos el símbolo del metal (Fe) seguido por el símbolo del no metal (Cl):

Al separarse de 3 OH-, se forma el ion férrico con carga +3 (Fe3+), de manera similar, al separarse del H+, el cloro forma el ion Cl- (con una carga negativa).
Paso 8: Escribimos la carga del Cloro como subíndice del Hierro y viceversa para lograr la electroneutralidad:
Paso 9: Revisamos si la ecuación esta balanceada:
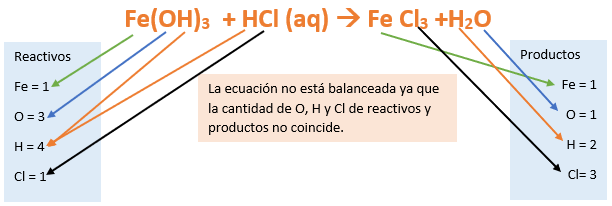
Paso 10: Finalmente, si la ecuación no se encuentra balanceada, es preciso realizar esta operación.
Una forma sencilla de balancear la ecuación consiste en igualar la cantidad de H y OH- que tenemos en reactivos y luego balancear el agua. Para ello agregamos un coeficiente 3 frente al HCl (como el hidróxido tiene 3 OH- necesitamos 3 H del ácido). Como en reactivos tenemos 3 OH- y 3 H, a partir de estos se deberían formar 3 moléculas o moles de H2O, por ello agregamos un coeficiente 3 frente a este compuesto:
- Y de esta manera obtenemos la ecuación balanceada del Cloruro Férrico
Autor: Holzmaisters Jonathan.

Para repasar lo que leíste, te proponemos que observes y tomes nota del siguiente video tutorial. Autor: Holzmaisters Jonathan.

Ahora te proponemos que realices una actividad de formulación y nomenclatura de las hidrosales. Para acceder haz CLIC AQUÍ.
