FORMULACIÓN Y NOMENCLATURA DE COMPUESTOS INORGÁNICOS PARTE II

Imagen extraída de: https://concepto.de/compuesto-quimico/
2. COMPUESTOS TERNARIOS: HIDRÓXIDOS Y OXOÁCIDOS
2.2. Oxoácidos
En el libro anterior pudiste leer sobre un tipo de ácidos, los hidrácidos. En este apartado te invitamos a aprender sobre otro tipo de ácidos, los Oxoácidos. El prefijo “oxo” se utiliza para indicar que este compuesto posee Oxígeno en su estructura química, elemento que no se hallaba en los ácidos estudiados en el libro anterior.
Los oxoácidos son compuestos ternarios de hidrógeno, oxígeno y un elemento electronegativo, generalmente no metálico (también puede ser un elemento de transición con número de oxidación elevado), que se obtienen de la combinación de un anhídrido con agua mediante la siguiente ecuación general:
Anhídrido + H2O --> Oxoácido
Ejemplo: N2O3 + H2O -------> 2HNO2
Fórmula Química: La fórmula general de los oxoácidos es HaNbOc, siendo N un elemento electronegativo (no metálico, en la mayoría de los casos). El subíndice que acompaña a cada uno de estos elementos está determinado por el número de átomos que hay de cada uno de ellos en el lado de los reactivos, si son múltiplos se simplifican.
Ejemplo: 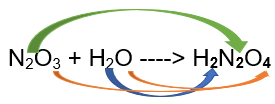 ➡️
➡️ 
En estos compuestos:
- El hidrógeno actúa con número de oxidación I.
- El oxígeno actúa con número de oxidación –II.
- El elemento electronegativo, generalmente no metálico, actúa con un número de oxidación positivo, n. Si tenemos en cuenta que la suma de los números de oxidación positivos debe compensar la de los números negativos para que la molécula sea neutra, podemos deducir el valor de n a partir de los subíndices de la fórmula química, mediante la siguiente ecuación:
![]()
Nomenclatura:
Según la nomenclatura tradicional:
➡️ Si el no metal con el que se combina tiene dos valencias se utilizan los sufijos “oso” e “ico” y se suprime la sílaba “de”:
⏺️“oso” cuando el elemento usa la menor valencia; Ejemplo: HNO2, valencia del nitrógeno (III): Ácido nitroso
⏺️“ico” cuando el elemento va con la mayor valencia; Ejemplo: HNO3, valencia del nitrógeno (V): Ácido nítrico.
Para diferenciar a estos oxácidos, en el sistema tradicional, se utilizan tres prefijos dependiendo de cuantas moléculas de agua se combinan con cada molécula de anhídrido.
Estos son:
- meta-… (1 molécula de agua)
- piro-… (2 moléculas de agua)
- orto-… (3 moléculas de agua) este prefijo se puede omitir
Ejemplo:
P2O5 + H2O -----> H2P2O6; 2 HPO3 Ácido metafosfórico
P2O5 + 2H2O -----> H4P2O7; H4P2O7 Ácido pirofofórico
P2O5 + 3H2O -----> H6P2O8; 2 H3PO4 Ácido ortofosfórico
Ahora te proponemos que leas con atención el siguiente tutorial paso a paso para formular un Oxoácido.
Tutorial paso a paso 2: Formación de un oxoácido a partir de su nombre
En este tutorial plantearemos la ecuación de formación de un oxoácido, con el objetivo de obtener su fórmula, usando como referencia el nombre que obtiene por nomenclatura tradicional.
Vamos paso a paso:
Paso 1: En primer lugar, debemos conocer el nombre del compuesto y a partir del mismo, y junto a las reglas de nomenclatura poder extraer la información necesaria:

Paso 2: En cálculos auxiliares formamos el anhídrido bromoso (puedes ayudarte con el tutorial de formación de anhídridos), en este caso no balancearemos la ecuación, ya que solo nos interesa la formula del anhídrido:
Calculo Auxiliar:
En la tabla periódica buscamos los números de oxidación de cada elemento:
Teniendo en cuenta el nombre del compuesto seleccionamos el número de oxidación o valencia correspondiente para cada elemento:
El O utilizará el -2 ya que se trata de un óxido, y el Br el +3, ya que el nombre termina en “oso”.
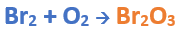
Paso 3: Escribimos las fórmulas de los reactivos, en este caso el anhídrido que formulaste en el paso anterior (Br2O3) y agua (H2O), separados por un signo + (no importa el orden de los reactivos, puede escribirse el Br2O3 o el H2O primero y luego el otro):
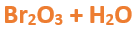
Paso 4: Luego de los reactivos agregamos la flecha de reacción (-->):

Paso 5: Empezamos a platear la fórmula del oxoácido, para ello después de la flecha de reacción escribimos el símbolo de cada elemento en el siguiente orden: hidrógeno, no metal (Br) y oxígeno (sin separarlos con +):

Paso 6: Contamos la cantidad de átomos de cada elemento en Reactivos, luego escribimos estos valores como subíndices en cada uno de los elementos del producto.
- Como en reactivos hay 2 de átomos de hidrógeno (presentes en el agua) en el hidrógeno del producto agregamos un subíndice 2.
- En reactivos hay 2 átomos de bromo (presentes en el anhídrido) entonces agregamos un subíndice 2 en el bromo del producto.
- Al tener 4 átomos de oxígeno en reactivos (3 en el anhídrido + 1 en el agua) escribimos un subíndice 4 en el oxígeno del producto.
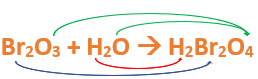
Importante: siempre que, en un compuesto todos los subíndices sean múltiplos entre sí, es necesario simplificarlos, para obtener la formula correcta. En este caso debemos dividir todos los subíndices por 2, quedando la fórmula de la siguiente manera:

Paso 7: Revisamos si la ecuación está balanceada:
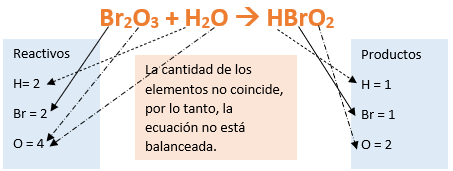
Paso 8: Finalmente, si la ecuación no se encuentra balanceada, debemos realizar esta operación mediante el uso de coeficientes estequiométricos.
En este caso se debe agregar un 2 delante del HBrO2 en productos para que la cantidad de hidrógeno, bromo y oxígeno coincida:
- Y de esta manera obtenemos la ecuación balanceada del Ácido Bromoso.
Autor: Holzmaisters Jonathan.

Para repasar lo que leíste, te proponemos que observes y tomes nota del siguiente video tutorial. Autor: Holzmaisters Jonathan.

Ácido sulfúrico:
Una gran parte se emplea en la obtención de fertilizantes. También se usa para la síntesis de otros ácidos y sulfatos y en la industria petroquímica. También se lo emplea en la elaboración de baterías, como las baterías de los automóviles.
Ácido nítrico:
Es utilizado comúnmente como un reactivo de laboratorio, se utiliza para fabricar explosivos como la nitroglicerina y trinitrotolueno (TNT), así como fertilizantes como el nitrato de amonio. Tiene usos adicionales en metalurgia y en refinado, ya que reacciona con la mayoría de los metales y en la síntesis química.
Acido carbónico:
Empleado en gaseosas, y distintas clases de refrescos.
Fuente: https://es.slideshare.net/Romelitoop/compuestos-usos-fiscoqumica

Ahora te invitamos a realizar una actividad de formulación y nomenclatura de oxoácidos. Para acceder haz CLIC AQUÍ.
