LA TABLA PERIÓDICA DE LOS ELEMENTOS
3. LA TABLA PERIÓDICA Y LA ESTRUCTURA ELECTRÓNICA DE LOS ÁTOMOS
3.1. PROPIEDADES PERIÓDICAS
Vamos a empezar a desarrollar esta última etapa que tiene que ver con la Tabla Periódica y, específicamente, con sus Propiedades Periódicas.
Te Invitamos a que realices una lectura comprensiva del siguiente texto y luego desarrolles las actividades sobre la Tabla Periódica que al final de este bloque se presenta.
¿Cuales son las Propiedades Periódicas?
En la Tabla Periódica, donde los elementos están ordenados por sus números atómicos (Z) crecientes, se observa una variación sistemática de ciertas propiedades, denominadas propiedades periódicas, tales cómo:
Radio Atómico...
En razón de que los Átomos tienen forma esférica se ha establecido que el radio atómico es la distancia existente entre el centro del núcleo y el electrón mas externo.
Al observar los radios atómicos de los elementos en la tabla periódica se observa que:
-
En un mismo período, el radio atómico disminuye de izquierda a derecha. esta variación se atribuye al aumento de la carga nuclear. Así, por ejemplo, el núcleo del Li con +3 atrae menos a los electrones que el F CON +9 y, por lo tanto, éste tiene átomos de diámetro menor. los gases inertes constituyen una excepción a este comportamiento, pues al tener un numero mayor de electrones en su ultima órbita, la repulsión eléctrica que se establece entre ellos por ser todos negativos produce un incremento del radio atómico.
- En un mismo grupo, el radio atómico aumenta de arriba hacia abajo. el incremento del radio atómico es consecuencia del aumento del numero de órbitas. Si bien la carga nuclear aumenta de +1 en el H a + 87 en el Fr, las capas electrónicas producen un "efecto pantalla" que reduce la atracción que ejerce sobre los electrones el núcleo positivo. La variación del radio atómico en la Tabla Periódica puede esquematizarse así:
Radio Iónico...
En el caso de los iones, cuya forma es esférica, radio iónico es la distancia que hay entre el centro del núcleo y la orbita electrónica externa.
Cuando un átomo neutro cede electrones, transformándose en catión, su radio disminuye. Así, por ejemplo, el átomo de sodio cuyo radio es 1,86 Å, al convertirse en catión reduce su radio a 0,95 Å.
En cambio, si un átomo gana electrones completando su ultima orbita con ocho electrones, se transforma en anión y su radio aumenta. este aumento se explica por la repulsión eléctrica entre los electrones de modo similar a o antes señalado para los gases inertes. En el flúor, por ejemplo, el radio atómico es de 0,64 Å, mientras que el radio Iónico de su anión aumenta a 1,36 Å.
Energía o Potencial de Ionización...
Cuando a un átomo neutro se le quita un electrón se ioniza, transformándose en un catión. Así, si a un átomo de Litio se le arrebata un electrón se convierte en un catión de Litio con una carga positiva, lo cual puede expresarse del siguiente modo:
Li° → Li+ + 1ê
El proceso para arrancar un electrón, requiere una cierta cantidad de energía que se denomina energía o potencial de ionización y que se puede definir así:
Para expresar la energía de ionización se suele utilizar una unidad muy pequeña, denominada electrón-volt (eV), que es equivalente a 1,6*1019 Joule.
Así, en el caso del Litio, se necesita una energía de 5,4 electrón-volt para quitarle un electrón.
El potencial de ionización también resulta ser una función periódica del numero atómico. El análisis de su variación dentro de la Tabla Periódica nos muestra lo siguiente:
- Dentro de cada período, se puede observar que el potencial de ionización se va modificando de un modo semejante al que transcribimos a continuación, correspondiente al 2° período:
El incremento que se observa en el potencial de ionización esta relacionado con el aumento del número atómico, o sea, con la carga nuclear positiva que atrae mas a los electrones negativos. También, se puede ver que el potencial de ionización es mas bajo en los metales alcalinos y va aumentando hasta alcanzar sus valores mas elevados en los gases inertes. Esto explica porque esos gases tienen una estructura atómica mas estable, dado que es necesaria una mayor cantidad de energía para remover un electrón.
La observación de los diversos períodos de la Tabla Periódica nos permite señalar lo siguiente:
- En cada uno de los grupos de la Tabla Periódica se puede ver una variación del potencial de ionización similar a la siguiente, correspondiente al grupo 1:
Al aumentar el número atómico se incrementa el numero de orbitas y, por lo tanto, se reduce la atracción entre el núcleo y los electrones externos. Entonces, se requiere menos energía para arrancar un electrón. El análisis de los distintos grupos que conforman la Tabla Periódica permite llegar a la siguiente conclusión:
En forma esquemática se puede expresar la variación del potencial de ionización en la Tabla Periódica de la siguiente forma:
Al aumentar el número atómico se incrementa el número de órbitas y, por lo tanto, se reduce la atracción entre el núcleo y los electrones externos. Entonces, se requiere menos energía para arrancar un electrón. El análisis de los distintos grupos que conforman la Tabla Periódica permite llegar a la siguiente conclusión:
En un mismo grupo de la Tabla Periódica, el potencial de ionización disminuye de arriba hacia abajo.
En forma esquemática se puede expresar la variación del potencial de ionización en la tabla Periódica de la siguiente forma:
Afinidad Electrónica...
En determinados casos, no solo es posible quitar electrones de los átomos sino también adicionarlos.
En la propiedades químicas de los elementos ejerce una considerable influencia la tendencia de un átomo neutro a capturar electrones para adquirir la configuración electrónica del gas inerte mas cercano, transformándose en anión. Así, los átomos de los halogenos del grupo 17, al recibir un electrón adquieren mayor estabilidad y por eso liberan una cantidad de energía que se denomina afinidad electrónica.
En consecuencia se puede establecer que:
Afinidad electrónica es la energía que se libera cuando un átomo neutro gana un electrón.
Esta afinidad se mide en electrón-volt (eV).
Los no metales, en especial los del grupo 17, tienen una afinidad electrónica elevada. A modo de ejemplo se pueden señalar los siguientes valores en eV: Flúor = 3,6; Cloro =3,75; Bromo = 3,53; Iodo =3,2; Oxígeno= 2,2.
En cambio, los metales, y en particular alcalinos, poseen afinidades electrónicas muy bajas.
Electronegatividad...
La Electronegatividad es una propiedad periódica que mide la tendencia que tiene un átomo, dentro de una molécula, para atraer a los electrones.
Los elementos mas electronegativos de la Tabla Periódica son los halógenos, siendo el Flúor (F) el que presenta el valor mas elevado, adoptando un valor arbitrario igual a 4.
Tener en cuenta las siguientes cuestiones:
♦ La electronegatividad decrece a lo largo de cada familia de la tabla.
♦ La electronegatividad crece a lo largo de cada periodo de la tabla.
♦ Los gases nobles no tienen electronegatividad porque no forman enlaces con ningún elemento.
A continuación te dejamos un esquema que sintetiza este último tema.
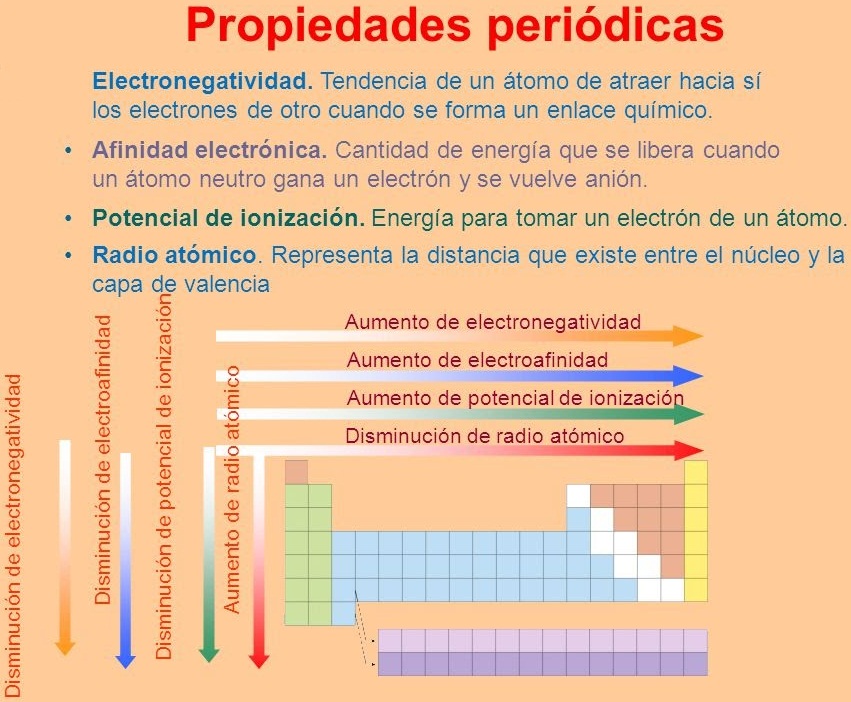
Imagen Recuperada de: propiedades periódicas-Bing images
Para finalizar te facilitamos un enlace Una Visualización 3D de la Tabla Periódica para que puedas navegar, explorar y conocer un poco mas sobre la Tabla Periódica.

Ahora que terminaste de leer este libro, te invitamos a que completes el CUESTIONARIO DEL TEMA, dónde encontrarás actividades relacionadas a todo lo abordado en este material.
