LA TABLA PERIÓDICA DE LOS ELEMENTOS
| Sitio: | Educación a Distancia - UNaM |
| Curso: | Química |
| Libro: | LA TABLA PERIÓDICA DE LOS ELEMENTOS |
| Imprimido por: | Cuenta visitante |
| Día: | jueves, 16 de octubre de 2025, 00:25 |
1. INTRODUCCIÓN
En este libro vas a encontrar...

Hasta el momento aprendiste qué elemento, en el contexto de las ciencias naturales, implica una clase de átomo, y al mismo tiempo aprendiste que son los bloques de construcción de todo lo que nos rodea.
En este libro examinaremos cómo se representa cada elemento, desarrollaremos cómo se clasifican y se ordenan en la Tabla Periódica. Te presentaremos los conceptos de estructura electrónica y propiedades periódicas .
Al finalizar, te proponemos una serie de actividades que te ayudarán a fijar los conceptos desarrollados.
2. SÍMBOLOS QUÍMICOS
Cada elemento químico se representa por medio de abreviaturas llamadas símbolos químicos. Estas abreviaturas derivan de las primeras letras del nombre del elemento y están formadas por una o dos letras. La primera letra del símbolo se escribe con imprenta mayúscula, y la segunda, si la hay, con minúscula como se observa en las imágenes a la derecha del texto.
RECORDÁ...
SABES...
Muchos nombres de elementos provienen del latín, como por ejemplo "azufre", que deriva de sulphur (S). Como también el nombre de la plata, que procede de su nombre en latín argentum (Ag) o el hierro, ferrum (Fe). Es por ello que sus símbolos químicos no concuerdan con las primeras letras de su nombre en español.
Veamos otros casos:
|
Nombre en español |
Nombre en latín |
Símbolo químico |
|
sodio |
natrium |
Na |
|
potasio |
kalium |
K |
|
cobre |
cuprum |
Cu |
|
oro |
aureum |
Au |
|
mercurio |
hidrargirium |
Hg |
|
fósforo |
phosphorus |
P |
|
azufre |
sulphur |
S |
|
antimonio |
stibium |
Sb |
Algunos elementos tomaron nombres de continentes o países como francio (Fr), americio (Am) o europio (Eu). A veces el nombre del elemento alude a alguna propiedad de la sustancia como en el caso del hidrógeno, que se representa con la letra H pero su nombre indica hidros - agua y genos - generador, o sea, “el que genera agua”.
Hay elementos cuyo nombre constituye una forma de homenajear a un científico, como mendelevio (Md) en honor a Mendeléiev, o nobelio (No), por Alfred Nobel.
Fuente: parte de los textos fue extraído del libro “QUÍMICA Aula Taller, General e Inorgánica”, José Mautino, Editorial Stella.
2.1. ORGANIZACIÓN DE LOS ELEMENTOS
UN POCO DE HISTORIA...
Como estuvimos trabajando en la sección anterior, cuando hablamos de elemento hacemos referencia a un tipo de átomo, o bien, a los "bloques de construcción" de todo lo que nos rodea.
Los químicos del siglo XIX encontraron entonces la necesidad de ordenar los nuevos elementos descubiertos.
La primera manera, la más natural, fue la de clasificarlos según sus masas atómicas, pero esta clasificación no reflejaba las diferencias y similitudes entre los elementos. Muchas más clasificaciones fueron adoptadas antes de llegar a la tabla
periódica que es utilizada en nuestros días.
A continuación te presentamos una cronología de algunas propuestas de clasificación de los elementos químicos:
DÖBEREINER:
En 1817, este químico alcanzó a elaborar un informe que mostraba una relación entre la masa atómica de ciertos elementos y sus propiedades. Destaca la
existencia de similitudes entre elementos agrupados en trías que él denomina “tríadas”. Podemos señalar como ejemplo la tríada del cloro, del bromo y del
yodo, que pone en evidencia que la masa de uno de los tres elementos de la tríada es intermedia entre la de los otros dos. En 1850 se pudo contar con unas 20 tríadas para llegar a una primera clasificación coherente.
MEYER:
En 1869, Meyer, químico alemán, muestra una cierta periodicidad en el volumen atómico. Los elementos similares tienen un volumen atómico similar en relación con los otros elementos. Los metales alcalinos tienen por ejemplo un volumen atómico importante.
MENDELEÏEV:
En 1872, un químico ruso, Dimitri Mendeleiev, ordenó 60 elementos conocidos en la época, en grupos con propiedades similares y los colocó en orden de masa atómica creciente. Actualmente, este ordenamiento de 118 elementos de los 92 son naturales se basa en el NÚMERO ATÓMICO creciente y se conoce como TABLA PERIÓDICA.
En 1869, Mendeleiev, químico ruso, presenta una primera versión de su tabla periódica. Esta tabla fue la primera presentación coherente de las semejanzas de los elementos. Se dio cuenta de que clasificando los elementos según sus masas atómicas se veía aparecer una periodicidad en lo que concierne a ciertas propiedades de los elementos. La primera tabla contenía 63 elementos.
Esta tabla fue diseñada para poder mostrar la periodicidad de los elementos. De esta manera los elementos son clasificados verticalmente y horizontalmente.
Para poder aplicar la ley que él creía cierta, tuvo que dejar ciertos huecos vacíos.
Estaba convencido de que un día esos lugares vacíos, no lo estarían más. Los descubrimientos futuros confirmaron esta convicción.
Consiguió además prever las propiedades químicas de tres de los elementos que faltaban, a partir de las propiedades de los cuatro elementos vecinos. Entre 1875 y 1886, estos tres elementos: galio, escandio y germanio, fueron descubiertos y ellos poseían las propiedades que él predijo.
Sin embargo aunque la clasificación de Mendeleiev marca un claro progreso, contiene ciertas anomalías debidas a errores de determinación de masa atómica de la época.
Por esto, MOSELEY introdujo, en el año 1913, el siguiente criterio:
"Las propiedades de los elementos son una función periódica de su número atómico. Desde ese entonces los elementos se han ordenado por su números atómicos crecientes, lo cual ha permitido corregir algunos defectos de la tabla de mendeleiev".
¿CÓMO ES LA TABLA PERIÓDICA ACTUAL?...
Es importante que a partir de ahora tengan una tabla periódica disponible; de esa manera podrán ir siguiendo de manera práctica la lectura del material que se presenta a continuación.
La tabla periódica que se utiliza actualmente está relacionada con la estructura electrónica de los átomos. En ella se encuentran todos los elementos conocidos, tanto los 92 que se hallaron en la Naturaleza como los que se obtuvieron en el laboratorio por medio de reacciones nucleares.
Las principales características de la tabla periódica son:
-
- Los elementos están ordenados por su número atómico creciente (Z). Comienza por el 1H, sigue con el 2He, 3Li, 4Be, 5B, etc.
-
A cada elemento le corresponde un casillero donde figura su símbolo y otros datos, tales como el número atómico, el número másico, la configuración electrónica, etc.
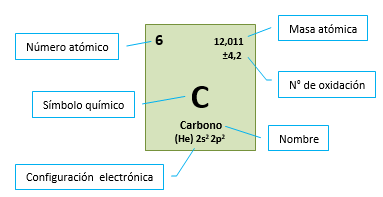
-
- Las filas horizontales se denominan períodos y las columnas verticales son conocidas como grupos o familias.
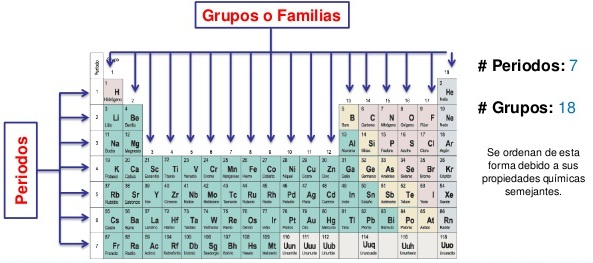
FUENTE: IMAGEN OBTENIDA DE TABLAS PERIÓDICAS PERIODOS Y GRUPOS - Bing images
-
- En total la tabla tiene 7 periodos que están numerados de manera creciente de arriba hacia abajo, desde 1 a 7.
- Las propiedades de los elementos de un período cambian de manera progresiva al recorrer la tabla.
- Cada grupo (columnas verticales) contiene una familia de elementos que tienen propiedades similares.
Coexisten dos maneras de referirse a los grupos: una de ellas los numera de 1 a 18 y van a través de toda la tabla, de izquierda a derecha. La otra utiliza números romanos del I al VIII, subdividiendo la tabla en dos tipos de grupos, los A y los B. Los grupos A se denominan representativos, mientras que con la letra B se designa a los elementos que ocupan el bloque central de la tabla periódica llamados elementos de transición.
Existe otro grupo de 28 elementos conocidos con el nombre de elementos de transición interna. Éstos por comodidad se ubican aparte pero corresponden al 6° y 7° período de la tabla. También son conocidos como Lantánidos y Actínidos.
Muchos grupos de la tabla periódica reciben nombres especiales: el grupo 1 o IA, metales alcalinos (Li, Na, K, etc.); los del grupo 17 o VIIA son los halógenos (F, Cl, Br, I, At) y los del grupo 18 o VIII gases nobles o inertes, denominados de esta manera por su escasa reactividad química (He, Ne, Ar, Kr, Zn, Rn).
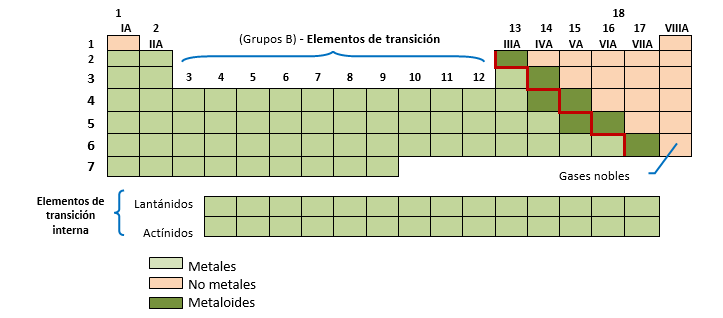
Resumiendo, podemos definir al sistema periódico actual en los siguientes términos: Las propiedades de los elementos químicos son una función periódica (cíclica) del número atómico.
En otras palabras también podemos decir:
Fuente: El siguiente texto fue extraído del libro “QUÍMICA Aula Taller, General e Inorgánica”, José Mautino, Editorial Stella.
2.2. METALES, NO METALES, METALOIDES Y GASES NOBLES
ALGO MAS SOBRE LOS ELEMENTOS QUÍMICOS...
ALGO MAS SOBRE LOS ELEMENTOS QUÍMICOS...
Otra forma de clasificación agrupa a los elementos en metales, no metales, metaloides y gases nobles . Esta clasificación es un tanto arbitraria y hay varios elementos que no se adaptan bien a cualquiera de estas clases.
La tabla periódica posee una línea gruesa en zigzag, indicada en color rojo en el esquema que se presenta, que separa los elementos metálicos de los no metálicos. Los de la izquierda de la línea son los metales, a excepción del hidrógeno, y los no metales son los de la derecha.
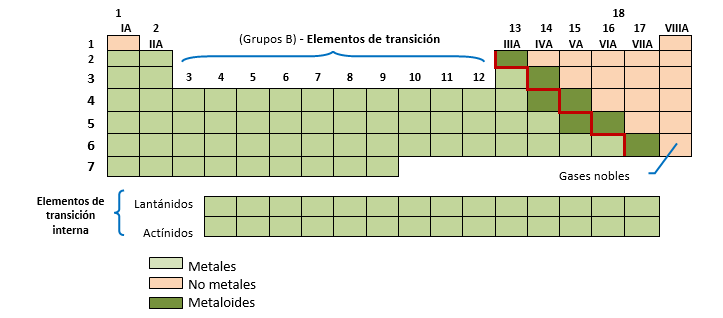
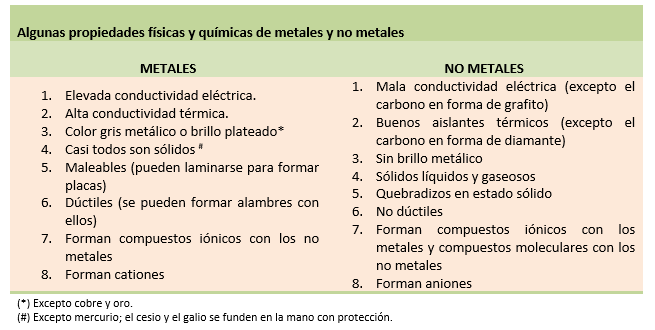
Los metaloides o semi metales, son elementos que muestran propiedades típicas tanto de los metales como de los no metales. Son mejores conductores del calor y la electricidad que los no metales, pero no tanto como los metales. En la tabla periódica, los metaloides (B, Si, Ge, As, Sb, Te, Po y At) se ubican a ambos lados de la línea gruesa que separa los metales de los no metales.
Finalmente y retomando lo mencionado en la hoja anterior, en el grupo 18 o VIII encontramos a los gases nobles que presentan las siguientes características:
-
- son gases Monoatómicos
- son inertes:
- denominados de esta manera por no presentar actividad química. Esto se debe a que poseen su capa de valencia completa de electrones; son el (He, Ne, Ar, Kr, Zn, Rn).
FUENTE: Imagen tomada de Química: Introducción a la tabla periódica-You Tube.
3. LA TABLA PERIÓDICA Y LA ESTRUCTURA ELECTRÓNICA DE LOS ÁTOMOS
¿A qué nos referimos cuando hablamos de la configuración electrónica de un átomo?...
La mayor parte del átomo es espacio vacío en donde los electrones se mueven libremente, lo que significa que poseen energía. Pero no todos tienen la misma energía, sino que se van agrupando en diferentes niveles energéticos.
Los niveles de energía de un átomo se pueden pensar como los distintos escalones de una escalera. A medida que subes o bajas la escalera, debes pasar de un escalón a otro, y no puedes detenerte en un nivel entre los mismos. En los átomos sólo hay electrones en los niveles energéticos disponibles y la energía total (tanto cinética como potencial) de un electrón cambia conforme se mueve de un nivel a otro dentro del átomo.
El número máximo de electrones permitidos en cada nivel energético está dado por:
Principio de mínima energía...
Los electrones se ubican en un átomo de tal manera que les corresponda el menor valor de energía posible, es decir, comenzando desde los niveles que se encuentran más cerca del núcleo.
El esquema de llenado de los orbitales atómicos, lo podemos obtener aplicando la regla de la diagonal, para ello se debe seguir atentamente la flecha del esquema comenzando en 1s.
Se debe señalar que el subnivel 4s posee menos energía que el 3d, y el 5s menos que el 4d; como los orbitales se llenan de acuerdo con estados de energía crecientes, estas alteraciones se deben tener en cuenta para escribir correctamente la configuración electrónica de los distintos elementos.
La configuración electrónica de un átomo o elemento se simboliza de la siguiente manera:

En función del tipo de orbitales que se están llenando, la Tabla Periódica se divide en cuatro bloques fundamentales:
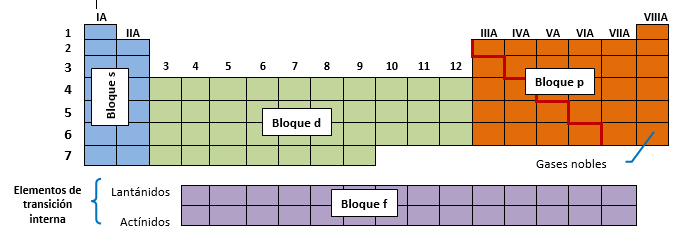
Electrones de valencia...
Las propiedades químicas de los elementos representativos se deben, principalmente a los electrones de valencia, que son los electrones que se encuentran en los niveles energéticos externos. Estos son los electrones que intervienen en los enlaces químicos. Por ejemplo, el sodio (Na) al pertenecer al grupo IA, posee un único electrón de valencia y, por lo tanto, puede aportar un sólo electrón al formar enlaces.
Es importante resaltar que los elementos representativos de un mismo grupo de la tabla periódica tienen igual número de electrones de valencia. Esta es la razón por la cual los elementos ubicados en un mismo grupo tienen propiedades químicas semejantes y sus propiedades físicas están relacionadas. Por ejemplo, el oxígeno (O) y el azufre (S) pertenecen al grupo VIA y ambos tienen 6 electrones de valencia.

3.1. PROPIEDADES PERIÓDICAS
Vamos a empezar a desarrollar esta última etapa que tiene que ver con la Tabla Periódica y, específicamente, con sus Propiedades Periódicas.
Te Invitamos a que realices una lectura comprensiva del siguiente texto y luego desarrolles las actividades sobre la Tabla Periódica que al final de este bloque se presenta.
¿Cuales son las Propiedades Periódicas?
En la Tabla Periódica, donde los elementos están ordenados por sus números atómicos (Z) crecientes, se observa una variación sistemática de ciertas propiedades, denominadas propiedades periódicas, tales cómo:
Radio Atómico...
En razón de que los Átomos tienen forma esférica se ha establecido que el radio atómico es la distancia existente entre el centro del núcleo y el electrón mas externo.
Al observar los radios atómicos de los elementos en la tabla periódica se observa que:
-
En un mismo período, el radio atómico disminuye de izquierda a derecha. esta variación se atribuye al aumento de la carga nuclear. Así, por ejemplo, el núcleo del Li con +3 atrae menos a los electrones que el F CON +9 y, por lo tanto, éste tiene átomos de diámetro menor. los gases inertes constituyen una excepción a este comportamiento, pues al tener un numero mayor de electrones en su ultima órbita, la repulsión eléctrica que se establece entre ellos por ser todos negativos produce un incremento del radio atómico.
- En un mismo grupo, el radio atómico aumenta de arriba hacia abajo. el incremento del radio atómico es consecuencia del aumento del numero de órbitas. Si bien la carga nuclear aumenta de +1 en el H a + 87 en el Fr, las capas electrónicas producen un "efecto pantalla" que reduce la atracción que ejerce sobre los electrones el núcleo positivo. La variación del radio atómico en la Tabla Periódica puede esquematizarse así:
Radio Iónico...
En el caso de los iones, cuya forma es esférica, radio iónico es la distancia que hay entre el centro del núcleo y la orbita electrónica externa.
Cuando un átomo neutro cede electrones, transformándose en catión, su radio disminuye. Así, por ejemplo, el átomo de sodio cuyo radio es 1,86 Å, al convertirse en catión reduce su radio a 0,95 Å.
En cambio, si un átomo gana electrones completando su ultima orbita con ocho electrones, se transforma en anión y su radio aumenta. este aumento se explica por la repulsión eléctrica entre los electrones de modo similar a o antes señalado para los gases inertes. En el flúor, por ejemplo, el radio atómico es de 0,64 Å, mientras que el radio Iónico de su anión aumenta a 1,36 Å.
Energía o Potencial de Ionización...
Cuando a un átomo neutro se le quita un electrón se ioniza, transformándose en un catión. Así, si a un átomo de Litio se le arrebata un electrón se convierte en un catión de Litio con una carga positiva, lo cual puede expresarse del siguiente modo:
Li° → Li+ + 1ê
El proceso para arrancar un electrón, requiere una cierta cantidad de energía que se denomina energía o potencial de ionización y que se puede definir así:
Para expresar la energía de ionización se suele utilizar una unidad muy pequeña, denominada electrón-volt (eV), que es equivalente a 1,6*1019 Joule.
Así, en el caso del Litio, se necesita una energía de 5,4 electrón-volt para quitarle un electrón.
El potencial de ionización también resulta ser una función periódica del numero atómico. El análisis de su variación dentro de la Tabla Periódica nos muestra lo siguiente:
- Dentro de cada período, se puede observar que el potencial de ionización se va modificando de un modo semejante al que transcribimos a continuación, correspondiente al 2° período:
El incremento que se observa en el potencial de ionización esta relacionado con el aumento del número atómico, o sea, con la carga nuclear positiva que atrae mas a los electrones negativos. También, se puede ver que el potencial de ionización es mas bajo en los metales alcalinos y va aumentando hasta alcanzar sus valores mas elevados en los gases inertes. Esto explica porque esos gases tienen una estructura atómica mas estable, dado que es necesaria una mayor cantidad de energía para remover un electrón.
La observación de los diversos períodos de la Tabla Periódica nos permite señalar lo siguiente:
- En cada uno de los grupos de la Tabla Periódica se puede ver una variación del potencial de ionización similar a la siguiente, correspondiente al grupo 1:
Al aumentar el número atómico se incrementa el numero de orbitas y, por lo tanto, se reduce la atracción entre el núcleo y los electrones externos. Entonces, se requiere menos energía para arrancar un electrón. El análisis de los distintos grupos que conforman la Tabla Periódica permite llegar a la siguiente conclusión:
En forma esquemática se puede expresar la variación del potencial de ionización en la Tabla Periódica de la siguiente forma:
Al aumentar el número atómico se incrementa el número de órbitas y, por lo tanto, se reduce la atracción entre el núcleo y los electrones externos. Entonces, se requiere menos energía para arrancar un electrón. El análisis de los distintos grupos que conforman la Tabla Periódica permite llegar a la siguiente conclusión:
En un mismo grupo de la Tabla Periódica, el potencial de ionización disminuye de arriba hacia abajo.
En forma esquemática se puede expresar la variación del potencial de ionización en la tabla Periódica de la siguiente forma:
Afinidad Electrónica...
En determinados casos, no solo es posible quitar electrones de los átomos sino también adicionarlos.
En la propiedades químicas de los elementos ejerce una considerable influencia la tendencia de un átomo neutro a capturar electrones para adquirir la configuración electrónica del gas inerte mas cercano, transformándose en anión. Así, los átomos de los halogenos del grupo 17, al recibir un electrón adquieren mayor estabilidad y por eso liberan una cantidad de energía que se denomina afinidad electrónica.
En consecuencia se puede establecer que:
Afinidad electrónica es la energía que se libera cuando un átomo neutro gana un electrón.
Esta afinidad se mide en electrón-volt (eV).
Los no metales, en especial los del grupo 17, tienen una afinidad electrónica elevada. A modo de ejemplo se pueden señalar los siguientes valores en eV: Flúor = 3,6; Cloro =3,75; Bromo = 3,53; Iodo =3,2; Oxígeno= 2,2.
En cambio, los metales, y en particular alcalinos, poseen afinidades electrónicas muy bajas.
Electronegatividad...
La Electronegatividad es una propiedad periódica que mide la tendencia que tiene un átomo, dentro de una molécula, para atraer a los electrones.
Los elementos mas electronegativos de la Tabla Periódica son los halógenos, siendo el Flúor (F) el que presenta el valor mas elevado, adoptando un valor arbitrario igual a 4.
Tener en cuenta las siguientes cuestiones:
♦ La electronegatividad decrece a lo largo de cada familia de la tabla.
♦ La electronegatividad crece a lo largo de cada periodo de la tabla.
♦ Los gases nobles no tienen electronegatividad porque no forman enlaces con ningún elemento.
A continuación te dejamos un esquema que sintetiza este último tema.
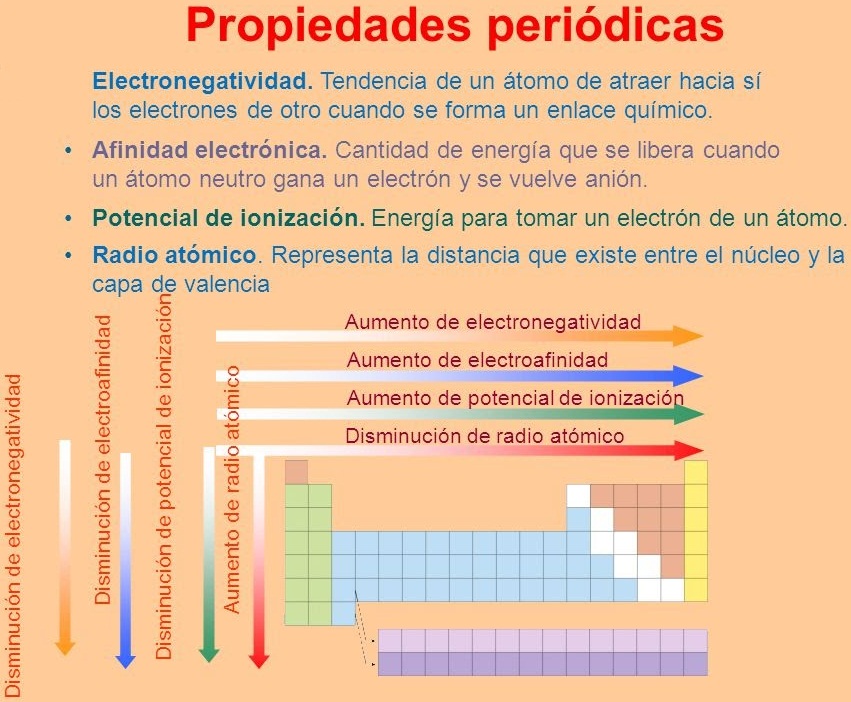
Imagen Recuperada de: propiedades periódicas-Bing images
Para finalizar te facilitamos un enlace Una Visualización 3D de la Tabla Periódica para que puedas navegar, explorar y conocer un poco mas sobre la Tabla Periódica.

Ahora que terminaste de leer este libro, te invitamos a que completes el CUESTIONARIO DEL TEMA, dónde encontrarás actividades relacionadas a todo lo abordado en este material.
4. REFERENCIAS
- Cabanne, Daniela; Fernández, Andrea. (2014). "Capítulo II: Clasificación periódica". Cuadernillo de Nivelación en Química. Facultad de Ciencias Forestales. UNaM.
-
“QUÍMICA Aula Taller, General e Inorgánica”, José Mautino, Editorial Stella.
- EL ORDENAMIENTO DE LOS ELEMENTOS: LA TABLA PERIÓDICA MODERNA. Cuadernillo de Nivelación. Facultad de Ciencias Forestales. UNaM. CURSILLO DE INGRESO 2013 – MÓDULO FÍSICO-QUÍMICA.
