LA TABLA PERIÓDICA DE LOS ELEMENTOS
3. LA TABLA PERIÓDICA Y LA ESTRUCTURA ELECTRÓNICA DE LOS ÁTOMOS
¿A qué nos referimos cuando hablamos de la configuración electrónica de un átomo?...
La mayor parte del átomo es espacio vacío en donde los electrones se mueven libremente, lo que significa que poseen energía. Pero no todos tienen la misma energía, sino que se van agrupando en diferentes niveles energéticos.
Los niveles de energía de un átomo se pueden pensar como los distintos escalones de una escalera. A medida que subes o bajas la escalera, debes pasar de un escalón a otro, y no puedes detenerte en un nivel entre los mismos. En los átomos sólo hay electrones en los niveles energéticos disponibles y la energía total (tanto cinética como potencial) de un electrón cambia conforme se mueve de un nivel a otro dentro del átomo.
El número máximo de electrones permitidos en cada nivel energético está dado por:
Principio de mínima energía...
Los electrones se ubican en un átomo de tal manera que les corresponda el menor valor de energía posible, es decir, comenzando desde los niveles que se encuentran más cerca del núcleo.
El esquema de llenado de los orbitales atómicos, lo podemos obtener aplicando la regla de la diagonal, para ello se debe seguir atentamente la flecha del esquema comenzando en 1s.
Se debe señalar que el subnivel 4s posee menos energía que el 3d, y el 5s menos que el 4d; como los orbitales se llenan de acuerdo con estados de energía crecientes, estas alteraciones se deben tener en cuenta para escribir correctamente la configuración electrónica de los distintos elementos.
La configuración electrónica de un átomo o elemento se simboliza de la siguiente manera:

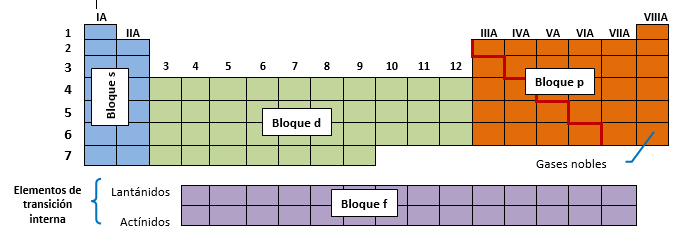
En función del tipo de orbitales que se están llenando, la Tabla Periódica se divide en cuatro bloques fundamentales:
Electrones de valencia...
Las propiedades químicas de los elementos representativos se deben, principalmente a los electrones de valencia, que son los electrones que se encuentran en los niveles energéticos externos. Estos son los electrones que intervienen en los enlaces químicos. Por ejemplo, el sodio (Na) al pertenecer al grupo IA, posee un único electrón de valencia y, por lo tanto, puede aportar un sólo electrón al formar enlaces.
Es importante resaltar que los elementos representativos de un mismo grupo de la tabla periódica tienen igual número de electrones de valencia. Esta es la razón por la cual los elementos ubicados en un mismo grupo tienen propiedades químicas semejantes y sus propiedades físicas están relacionadas. Por ejemplo, el oxígeno (O) y el azufre (S) pertenecen al grupo VIA y ambos tienen 6 electrones de valencia.

