LA TABLA PERIÓDICA DE LOS ELEMENTOS
2. SÍMBOLOS QUÍMICOS
2.1. ORGANIZACIÓN DE LOS ELEMENTOS
UN POCO DE HISTORIA...
Como estuvimos trabajando en la sección anterior, cuando hablamos de elemento hacemos referencia a un tipo de átomo, o bien, a los "bloques de construcción" de todo lo que nos rodea.
Los químicos del siglo XIX encontraron entonces la necesidad de ordenar los nuevos elementos descubiertos.
La primera manera, la más natural, fue la de clasificarlos según sus masas atómicas, pero esta clasificación no reflejaba las diferencias y similitudes entre los elementos. Muchas más clasificaciones fueron adoptadas antes de llegar a la tabla
periódica que es utilizada en nuestros días.
A continuación te presentamos una cronología de algunas propuestas de clasificación de los elementos químicos:
DÖBEREINER:
En 1817, este químico alcanzó a elaborar un informe que mostraba una relación entre la masa atómica de ciertos elementos y sus propiedades. Destaca la
existencia de similitudes entre elementos agrupados en trías que él denomina “tríadas”. Podemos señalar como ejemplo la tríada del cloro, del bromo y del
yodo, que pone en evidencia que la masa de uno de los tres elementos de la tríada es intermedia entre la de los otros dos. En 1850 se pudo contar con unas 20 tríadas para llegar a una primera clasificación coherente.
MEYER:
En 1869, Meyer, químico alemán, muestra una cierta periodicidad en el volumen atómico. Los elementos similares tienen un volumen atómico similar en relación con los otros elementos. Los metales alcalinos tienen por ejemplo un volumen atómico importante.
MENDELEÏEV:
En 1872, un químico ruso, Dimitri Mendeleiev, ordenó 60 elementos conocidos en la época, en grupos con propiedades similares y los colocó en orden de masa atómica creciente. Actualmente, este ordenamiento de 118 elementos de los 92 son naturales se basa en el NÚMERO ATÓMICO creciente y se conoce como TABLA PERIÓDICA.
En 1869, Mendeleiev, químico ruso, presenta una primera versión de su tabla periódica. Esta tabla fue la primera presentación coherente de las semejanzas de los elementos. Se dio cuenta de que clasificando los elementos según sus masas atómicas se veía aparecer una periodicidad en lo que concierne a ciertas propiedades de los elementos. La primera tabla contenía 63 elementos.
Esta tabla fue diseñada para poder mostrar la periodicidad de los elementos. De esta manera los elementos son clasificados verticalmente y horizontalmente.
Para poder aplicar la ley que él creía cierta, tuvo que dejar ciertos huecos vacíos.
Estaba convencido de que un día esos lugares vacíos, no lo estarían más. Los descubrimientos futuros confirmaron esta convicción.
Consiguió además prever las propiedades químicas de tres de los elementos que faltaban, a partir de las propiedades de los cuatro elementos vecinos. Entre 1875 y 1886, estos tres elementos: galio, escandio y germanio, fueron descubiertos y ellos poseían las propiedades que él predijo.
Sin embargo aunque la clasificación de Mendeleiev marca un claro progreso, contiene ciertas anomalías debidas a errores de determinación de masa atómica de la época.
Por esto, MOSELEY introdujo, en el año 1913, el siguiente criterio:
"Las propiedades de los elementos son una función periódica de su número atómico. Desde ese entonces los elementos se han ordenado por su números atómicos crecientes, lo cual ha permitido corregir algunos defectos de la tabla de mendeleiev".
¿CÓMO ES LA TABLA PERIÓDICA ACTUAL?...
Es importante que a partir de ahora tengan una tabla periódica disponible; de esa manera podrán ir siguiendo de manera práctica la lectura del material que se presenta a continuación.
La tabla periódica que se utiliza actualmente está relacionada con la estructura electrónica de los átomos. En ella se encuentran todos los elementos conocidos, tanto los 92 que se hallaron en la Naturaleza como los que se obtuvieron en el laboratorio por medio de reacciones nucleares.
Las principales características de la tabla periódica son:
-
- Los elementos están ordenados por su número atómico creciente (Z). Comienza por el 1H, sigue con el 2He, 3Li, 4Be, 5B, etc.
-
A cada elemento le corresponde un casillero donde figura su símbolo y otros datos, tales como el número atómico, el número másico, la configuración electrónica, etc.
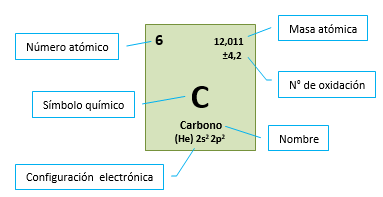
-
- Las filas horizontales se denominan períodos y las columnas verticales son conocidas como grupos o familias.
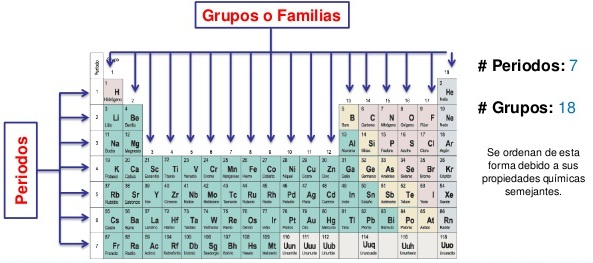
FUENTE: IMAGEN OBTENIDA DE TABLAS PERIÓDICAS PERIODOS Y GRUPOS - Bing images
-
- En total la tabla tiene 7 periodos que están numerados de manera creciente de arriba hacia abajo, desde 1 a 7.
- Las propiedades de los elementos de un período cambian de manera progresiva al recorrer la tabla.
- Cada grupo (columnas verticales) contiene una familia de elementos que tienen propiedades similares.
Coexisten dos maneras de referirse a los grupos: una de ellas los numera de 1 a 18 y van a través de toda la tabla, de izquierda a derecha. La otra utiliza números romanos del I al VIII, subdividiendo la tabla en dos tipos de grupos, los A y los B. Los grupos A se denominan representativos, mientras que con la letra B se designa a los elementos que ocupan el bloque central de la tabla periódica llamados elementos de transición.
Existe otro grupo de 28 elementos conocidos con el nombre de elementos de transición interna. Éstos por comodidad se ubican aparte pero corresponden al 6° y 7° período de la tabla. También son conocidos como Lantánidos y Actínidos.
Muchos grupos de la tabla periódica reciben nombres especiales: el grupo 1 o IA, metales alcalinos (Li, Na, K, etc.); los del grupo 17 o VIIA son los halógenos (F, Cl, Br, I, At) y los del grupo 18 o VIII gases nobles o inertes, denominados de esta manera por su escasa reactividad química (He, Ne, Ar, Kr, Zn, Rn).
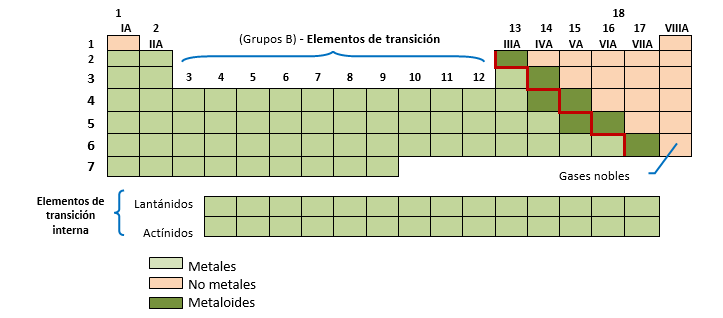
Resumiendo, podemos definir al sistema periódico actual en los siguientes términos: Las propiedades de los elementos químicos son una función periódica (cíclica) del número atómico.
En otras palabras también podemos decir:
Fuente: El siguiente texto fue extraído del libro “QUÍMICA Aula Taller, General e Inorgánica”, José Mautino, Editorial Stella.
