FORMULACIÓN Y NOMENCLATURA DE COMPUESTOS INORGÁNICOS PARTE I
 . . . Imagen extraída de: Cuaderno de cultura científica "De los compuestos químicos"
. . . Imagen extraída de: Cuaderno de cultura científica "De los compuestos químicos"
3. COMBINACIONES BINARIAS
3.2. Combinaciones Binarias con Oxígeno
Las combinaciones binarias con Oxígeno son comúnmente llamadas Óxidos. En general, los óxidos están formados por oxígeno y cualquiera de los restantes elementos de la tabla periódica. Excepto por el Flúor que, al ser más electronegativo que el oxígeno, en realidad forma el fluoruro de oxígeno y el Hidrógeno, ya explicado anteriormente. (Peterson, 2013).
Antes de comenzar a trabajar en los tipos de óxidos, te proponemos que realices la lectura del texto “Oxígeno” de Garrido y Bianchi, publicado en “El gato y la Caja”.
 Hubo una época en la que nadie podía decir de qué estaba formado el aire que los rodeaba, el agua que bebían, los alimentos que consumían o, incluso, sus propios cuerpos. Diferentes teorías intentaron explicar qué era el gas vital, ese que mantenía vivos a los animales, o qué componente tenían los materiales inflamables, como la madera (al que llamaban flogisto). Lejos estaban de conocer que había un compuesto común entre todas esas situaciones.
Hubo una época en la que nadie podía decir de qué estaba formado el aire que los rodeaba, el agua que bebían, los alimentos que consumían o, incluso, sus propios cuerpos. Diferentes teorías intentaron explicar qué era el gas vital, ese que mantenía vivos a los animales, o qué componente tenían los materiales inflamables, como la madera (al que llamaban flogisto). Lejos estaban de conocer que había un compuesto común entre todas esas situaciones.
Obvio que hoy, con el diario del lunes, las ideas que se planteaban podrían parecernos delirantes. Todos sabemos que ese gas que está en la atmósfera y nos permite obtener energía al respirar es el mismo que permite la combustión. Pero, ¿acaso en un tiempo no nos van a parecer delirantes las teorías que hacemos hoy sobre cosas que desconocemos, como la forma en la que la conciencia emerge del cerebro, o por qué no existen los dobles de miga?
A fines de 1700, Antoine Lavoisier y Marie Anne Pierrette Paulze no paraban de hacer experimentos prendiendo fuego cosas en ambientes cerrados. Lo que notaban era que había algo involucrado en ese proceso de combustión que no estaban viendo y que debía estar en el aire. Así fue como, entre otras cosas (incluidas tomar prestadas sin pedir permiso algunas ideas de un tal Joseph Priestley) bautizaron el oxígeno.
Claro que la cuestión no quedó ahí. A principios de 1800, Dalton propuso las bases de la teoría atómica, en la cual planteaba que cada elemento conocido estaba formado por un solo tipo de átomos, pero a su vez, distintos elementos podían combinarse entre sí, formando compuestos químicos. De esta forma, por ejemplo, el oxígeno se iba a combinar con el hidrógeno para formar el agua.
Como a toda buena historia, le falta una separación dramática. Fue Avogadro (uno que inventó una unidad de medir cantidades y tuvo la original idea de ponerle su nombre) quien vino a decirnos que en realidad existen distintas maneras en las que podemos encontrar el oxígeno: el gas oxígeno está formado únicamente por el átomo oxígeno, pero en realidad, hay dos átomos de oxígeno que pueden ser separados.
Para los que crean que Messi −Suarez − Neymar fue el mejor tridente de la historia: Lavoisier − Dalton − Avogadro pueden no haber ganado tanta plata ni partidos en tan poco tiempo, pero tienen buenos números.
El oxígeno está en todas partes. Tal vez por eso sea imposible contar su historia: habría que contar la historia del Universo y la del mundo, la historia de la vida y la historia de la historia que se está contando, y la historia del que escribe la historia y la del que la está leyendo y así, hasta quedarnos sin aire. (Garrido & Bianchi)
-
- Óxidos Básicos: Son compuestos binarios constituidos por un elemento metálico y Oxígeno, donde este último siempre trabaja con número de oxidación -2.
Se obtienen de acuerdo con la siguiente ecuación general:
Metal + O2 --> Óxido básico
Ejemplo: 2Fe + O2 --> 2FeO
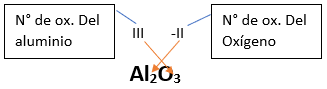
Fórmula Química: Queda determinada por el metal y el oxígeno, cuyas valencias o números de oxidación se intercambian y se anotan como subíndices.
En el caso de que sean múltiplos, se simplifican; por ejemplo:
Fe2O2 --> FeO
Nomenclatura:
Según la nomenclatura tradicional:
➡️ Si el metal con el que se combina el oxígeno tiene una sola valencia, se nombra con las palabras Óxido de..., y el nombre del metal con el que se combina. Ejemplo: Al2O3; Óxido de Aluminio.
➡️Si el metal con el que se combina al oxígeno tiene dos valencias se utilizan los sufijos “oso” e “ico” y se suprime la sílaba “de”:
⏺️ “oso” cuando el elemento usa la menor valencia; Ejemplo: FeO, valencia del hierro (II): Óxido ferroso
⏺️ “ico” cuando el elemento va con la mayor valencia; Ejemplo: Fe2O3, valencia del hierro (III): Óxido férrico.
Ahora te proponemos que leas con atención el siguiente tutorial paso a paso para formular un Óxido Básico.
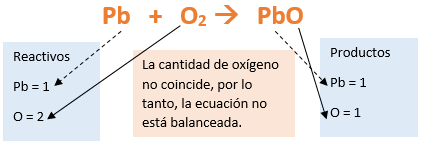
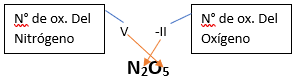
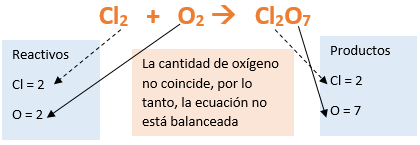
En este tutorial plantearemos la ecuación de formación de un oxido básico, con el objetivo de obtener su fórmula, usando como referencia el nombre que obtiene por nomenclatura tradicional. Vamos paso a paso: Paso 1: En primer lugar, debemos conocer el nombre del compuesto y a partir del mismo, y junto a las reglas de nomenclatura, extraer la información necesaria: Paso 2: Escribimos las fórmulas de los reactivos, en este caso, oxígeno (O2) y plomo (Pb), separados por un signo + (no importa el orden de los reactivos, puede escribirse el O2 o el Pb primero y luego el otro): Paso 3: Luego de los reactivos agregamos la flecha de reacción (-->): Paso 4: Empezamos a platear la fórmula del óxido, para ello escribimos el símbolo del metal (Pb) seguido del símbolo del oxígeno (sin separarlos con +), después de la flecha de reacción: Paso 5: En la tabla periódica buscamos los números de oxidación de cada elemento: Paso 6: Teniendo en cuenta el nombre del compuesto seleccionamos el número de oxidación o valencia correspondiente para cada elemento: El O utilizará el -2 y el Pb el +2 (menor), ya que el nombre termina en “oso”. Paso 7: Escribimos en lápiz los valores seleccionados anteriormente en números romanos sobre cada elemento (este paso es opcional): Paso 8: Escribimos el número de oxidación del oxígeno como subíndice del plomo y viceversa, luego borramos los números de oxidación que escribimos en lápiz: Importante: siempre que, en un compuesto todos los subíndices sean múltiplos entre sí, es necesario simplificarlos, para obtener la formula más sencilla del óxido. En este caso debemos dividir ambos subíndices por 2, quedando de la siguiente manera: Paso 9: Revisamos si la ecuación esta balanceada, para ello debemos verificar que cada elemento aparezca la misma cantidad de veces en reactivos y en productos: Paso 10: Finalmente, Si la ecuación no se encuentra balanceada, es preciso realizar esta operación, mediante el uso de los coeficientes estequiométricos. En este caso se debe agregar un 2 delante del PbO en productos para que coincida la cantidad de oxígeno y luego un 2 frente al Pb en reactivos para que la cantidad de plomo coincida: Autor: Holzmaisters Jonathan. Para repasar lo que leíste, te proponemos que observes y tomes nota del siguiente video tutorial. Autor: Holzmaisters Jonathan. Los óxidos básicos tienen un papel muy importante en la fabricación de muchos de los productos que utilizamos en el día a día. Por ejemplo: Óxido de Magnesio: Se utiliza para la preparación de medicamentos destinados al estómago, y en la fabricación de antídotos para intoxicaciones. Óxido de Zinc: Se utiliza para la fabricación de pinturas, colorantes y pigmentos de teñido. Óxido de Aluminio: Se utiliza para aleaciones de enorme dureza y otros metales de uso industrial. Óxido de Plomo: Se utiliza en la fabricación de vidrio. Te proponemos que realices una actividad sobre la formulación de los óxidos básicos. Para acceder haz CLIC AQUÍ. ______________________________________________________________________________________________________________________________ No metal + O2 --> Anhídrido Ejemplo: 2N2 + 5O2 --> 2N2O5 Fórmula Química: Queda determinada por el no metal y el oxígeno, cuyas valencias o números de oxidación se intercambian y se anotan como subíndices. En el caso de que sean múltiplos, se simplifican. Por ejemplo: S2O6 --> SO3 Nomenclatura: Según la nomenclatura tradicional: ➡️ Si el no metal con el que se combina el oxígeno tiene una sola valencia, se nombra con las palabras Anhídrido de..., y el nombre del metal con el que se combina. ➡️ Si el no metal con el que se combina al oxígeno tiene dos valencias se utilizan los sufijos “oso” e “ico” y se suprime la sílaba “de”: ⏺️ “oso” cuando el elemento usa la menor valencia; Ejemplo: N2O3, valencia del nitrógeno (III): Anhídrido nitroso. ⏺️ “ico” cuando el elemento va con la mayor valencia; Ejemplo: N2O5, valencia del nitrógeno (V): Anhídrido nítrico. ➡️ Si el no metal con el que se combina al oxígeno tiene cuatro valencias se utilizan prefijos “hipo” y “per” y los sufijos “oso” e “ico” y se suprime la sílaba “de”; por ejemplo: cloro, que posee las valencias 1, 3, 5 y 7. ⏺️ Cuando la valencia es 1, se utiliza el prefijo “hipo” y el sufijo “oso”; Anhídrido hipocloroso. ⏺️ Cuando la valencia es 3, se utiliza solamente el sufijo “oso”; Anhídrido cloroso. ⏺️ Cuando la valencia es 5, se utiliza solamente el sufijo “ico”; Anhídrido clórico. ⏺️ Cuando la valencia es 7, se utiliza el prefijo “per” y el sufijo “ico”; Anhídrido perclórico. Ahora te proponemos que leas con atención el siguiente tutorial paso a paso para formular un Óxido ácido o anhídrido. En este tutorial plantearemos la ecuación de formación de un anhídrido, con el objetivo de obtener su fórmula, usando como referencia el nombre que obtiene por nomenclatura tradicional. Vamos paso a paso: Paso 1: En primer lugar, debemos conocer el nombre del compuesto para, a partir de este y teniendo en cuenta las reglas de nomenclatura, poder extraer la información necesaria: Paso 2: Escribimos las fórmulas de los reactivos, en este caso oxígeno (O2) y cloro (Cl2), separados por un signo + (no importa el orden de los reactivos, puede escribirse el O2 o el Cl2 primero y luego el otro): Paso 3: Luego de los reactivos agregamos la flecha de reacción (-->): Paso 4: Empezamos a platear la formula del anhídrido, para ello escribimos el símbolo del no metal (Cl) seguido del símbolo del oxígeno (sin separarlos con +), después de la flecha de reacción: Paso 5: En la tabla periódica buscamos los números de oxidación de cada elemento: Paso 6: Teniendo en cuenta el nombre del compuesto seleccionamos el número de oxidación o valencia correspondiente para cada elemento: El O utilizará el -2 y el Cl el +7 (la mayor de los 4 positivos), ya que el nombre comienza con “per” y termina en “ico”. Paso 7: Escribimos en lápiz los valores seleccionados anteriormente en números romanos sobre cada elemento (este paso es opcional): Paso 8: Escribimos el número de oxidación del oxígeno como subíndice del cloro y viceversa, luego borramos los números de oxidación que escribimos en lápiz: Importante: siempre que, en un compuesto todos los subíndices sean múltiplos entre sí, es necesario simplificarlos, para obtener la formula correcta del anhídrido. En este caso los subíndices no cumplen con esta condición, por lo que se mantienen igual: Paso 9: Revisamos si la ecuación esta balanceada, para ello debemos verificar que cada elemento aparezca la misma cantidad de veces en reactivos y en productos: Paso 10: Finalmente, si la ecuación no se encuentra balanceada, debemos hacerlo empleando coeficientes estequiométricos. En este caso se debe agregar un 2 delante del Cl2O7 en productos y un 7 delante del O2 en los reactivos para que coincida la cantidad de oxígeno y luego se debe agregar un 2 frente al Cl2 en reactivos para que la cantidad de cloro coincida: Autor: Holzmaisters Jonathan. Para repasar lo que leíste, te proponemos que observes y tomes nota del siguiente video tutorial. Autor: Holzmaisters Jonathan. Óxido carbónico o dióxido de carbono: Es un gas incoloro y poco reactivo. Se halla en la tropósfera (capa atmosférica más cercana a la Tierra). Es un gas de efecto invernadero y el aumento de su concentración en la atmósfera está vinculado al cambio climático global, siendo uno de los casos mejor documentados. Fuente: Raynaud, D., J. Jouzel, J.M. Barnola, J. Chappellaz, R.J. Delmas & C. Lorius, 1993. The ice core record of greenhouse gases. Science, 259:926-934. Consultado en: https://www.mendoza.conicet.gov.ar/portal/enciclopedia/terminos/DioxiCar.htm Dióxido de Azufre: El dióxido de azufre se utiliza para fines muy diversos, por ej., como agente reductor en metalurgia, como frigorígeno en la industria del frío, como desinfectante y blanqueador, para la conservación de sustancias alimenticias, como decolorante y fumigante. El dióxido de azufre es uno de los compuestos más importantes de la industria química. El 98% del SO2 técnico se utiliza para la producción de trióxido de azufre como precursor del ácido sulfúrico. Fuente: http://wgbis.ces.iisc.ernet.in/energy/HC270799/HDL/ENV/envsp/Vol323.htm Óxidos de nitrógeno: Los óxidos de nitrógeno son una mezcla de gases compuestos de nitrógeno y oxígeno. El monóxido de nitrógeno y el dióxido de nitrógeno constituyen dos de los óxidos de nitrógeno más importantes toxicológicamente; ninguno de los dos son inflamables y son incoloros a pardo en apariencia a temperatura ambiente. Los óxidos de nitrógeno son usados en la producción de ácido nítrico, lacas, tinturas y otros productos químicos. Los óxidos de nitrógeno se usan en combustibles para cohetes, en la nitrificación de compuestos químicos orgánicos y en la manufactura de explosivos. Fuente: https://www.atsdr.cdc.gov/es/toxfaqs/es_tfacts175.html Te proponemos que realices una actividad sobre la formulación de los óxidos ácidos. Para acceder haz CLIC AQUÍ.
Tutorial paso a paso 4: Formación de un óxido básico a partir de su nombre
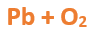



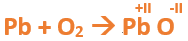
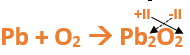
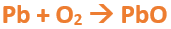



Tutorial paso a paso 5: Formación de un anhídrido a partir de su nombre
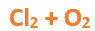

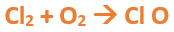

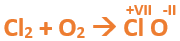
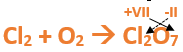
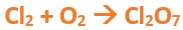



Ahora que terminaste de leer este libro, te invitamos a que realices el CUESTIONARIO DEL TEMA donde encontrarás actividades relacionadas a todo lo abordado en este material. Puedes comenzar haciendo CLIC AQUÍ.
