FORMULACIÓN Y NOMENCLATURA DE COMPUESTOS INORGÁNICOS PARTE I
| Sitio: | Educación a Distancia - UNaM |
| Curso: | Química |
| Libro: | FORMULACIÓN Y NOMENCLATURA DE COMPUESTOS INORGÁNICOS PARTE I |
| Imprimido por: | Cuenta visitante |
| Día: | jueves, 27 de noviembre de 2025, 10:19 |
Descripción
 . . . Imagen extraída de: Cuaderno de cultura científica "De los compuestos químicos"
. . . Imagen extraída de: Cuaderno de cultura científica "De los compuestos químicos"
1. INTRODUCCIÓN
En este libro vas a encontrar...

.
 En el libro que trabajaste la semana pasada, estuviste aprendiendo sobre la tabla periódica y sus elementos. En esta semana y la siguiente verás que esos elementos son capaces de formar sustancias o compuestos químicos en una amplia temática llamada Formulación y nomenclatura de compuestos inorgánicos.
En el libro que trabajaste la semana pasada, estuviste aprendiendo sobre la tabla periódica y sus elementos. En esta semana y la siguiente verás que esos elementos son capaces de formar sustancias o compuestos químicos en una amplia temática llamada Formulación y nomenclatura de compuestos inorgánicos.
A fines de facilitar la comprensión del proceso de formulación de compuestos inorgánicos, este primer libro está organizado de la siguiente manera:
CAPÍTULO: Conceptos básicos
-
- Compuestos Inorgánicos elementales y sus fórmulas químicas
-
- Reglas básicas de la nomenclatura.
-
- Concepto: Números de Oxidación.
CAPÍTULO: Compuestos Binarios
-
- Con Hidrógeno
-
- Con Oxígeno
En el segundo libro se abordan la Formulación y Nomenclatura de Oxoácidos, Hidróxidos y Sales Neutras.
Dentro de cada capítulo, los contenidos se presentan dentro de subcapítulos en los que podrás encontrar algunos textos de divulgación científica introductorios a los temas, el desarrollo del contenido teórico, así como también ejemplos y tutoriales en forma de texto y video.
Se podría decir que este tema es el ABECEDARIO de la Química, ya que es una de sus temáticas centrales; se trata de la base para muchos de los contenidos que verás en Química de la carrera. Es posible que a estos libros en particular tengas que dedicarles más tiempo que a los anteriores. Esto dependerá de tu experiencia en el estudio de esta asignatura y de tus conocimientos previos.
Para avanzar en este libro, te recomendamos leer con atención las explicaciones y ejemplos que se presenten, visualizar los videos tutoriales que se sugieren y realizar los ejercicios propuestos.
2. CONCEPTOS BÁSICOS
 El estudio de los compuestos químicos puede ser un poco abrumador al comienzo, por eso, es necesario que previamente realices una lectura de algunos conceptos que te serán muy útiles a la hora de aprender los distintos tipos de compuestos inorgánicos.
El estudio de los compuestos químicos puede ser un poco abrumador al comienzo, por eso, es necesario que previamente realices una lectura de algunos conceptos que te serán muy útiles a la hora de aprender los distintos tipos de compuestos inorgánicos.
En este capítulo del libro te proponemos que trabajes en torno a algunos contenidos generales, como ser: qué son los compuestos químicos, sustancias elementales y compuestas y las diferencias entre compuestos orgánicos e inorgánicos. Por otro lado, encontrarás material específico sobre formulación y nomenclatura: representación de fórmulas químicas y su significado, cómo se nombran a las sustancias químicas, qué es el número de oxidación y cómo se relaciona con este tema.
Aclaración: En este capítulo podrás ver que se utilizan los términos sustancias químicas y compuestos químicos como sinónimos.
Imagen extraída de: amoquímicos.com
2.1. Compuestos Químicos
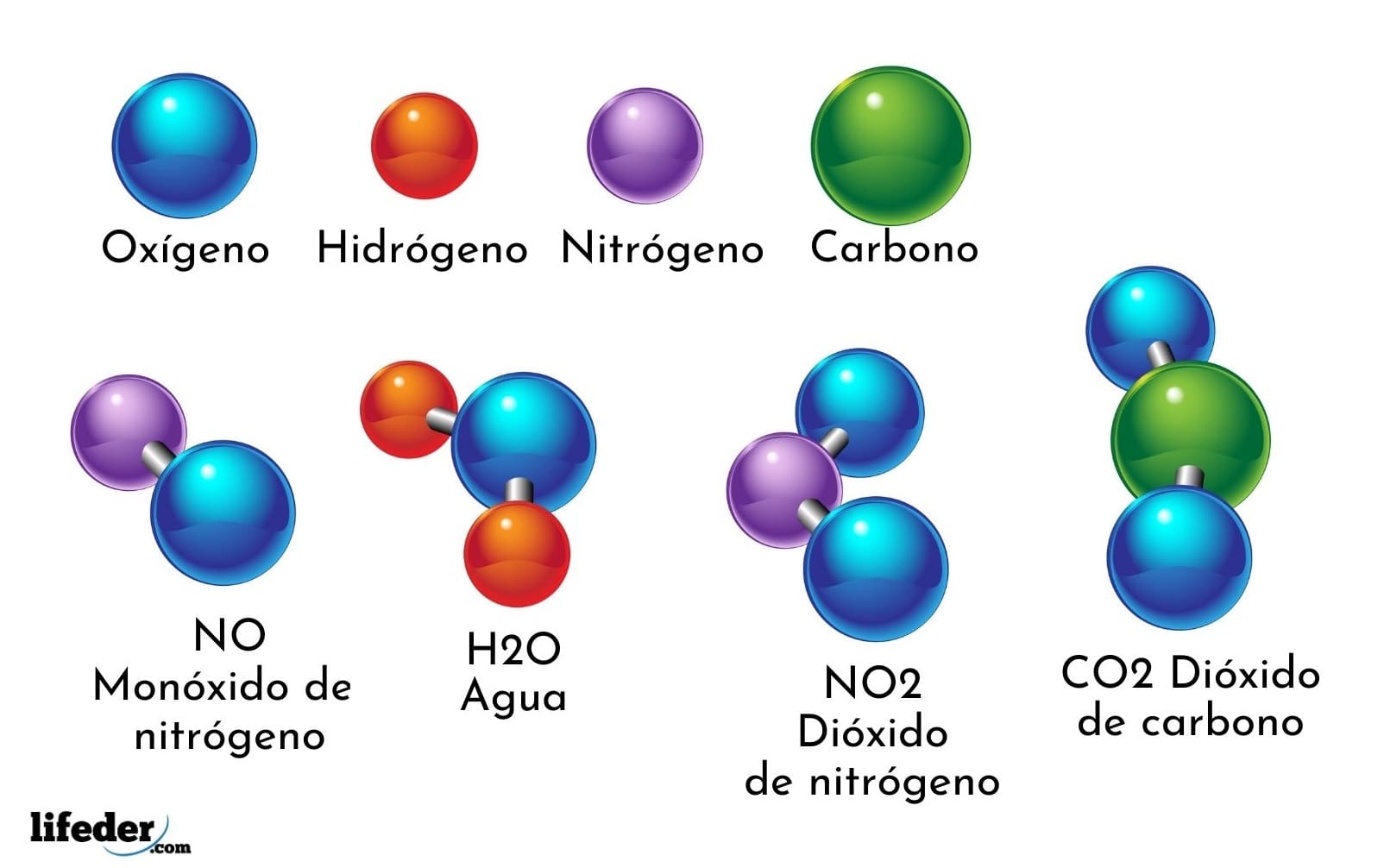 Un compuesto químico es una sustancia formada por dos o más átomos que se unen en proporciones definidas. Algunas de estas sustancias se denominan elementales, ya que son moléculas constituidas con átomos idénticos, es decir, del mismo elemento (Peterson, 2013). Por ejemplo, el Oxígeno atmosférico está formado por 2 átomos de ese mismo elemento y se simboliza como O2. Otro tipo son las sustancias compuestas, estas son moléculas que se constituyen de átomos de distintos elementos (Peterson, 2013). Un ejemplo de este tipo de sustancias es el agua, ya que se halla formada por 2 átomos del Hidrógeno y 1 átomo de Oxígeno, y se simboliza como H2O.
Un compuesto químico es una sustancia formada por dos o más átomos que se unen en proporciones definidas. Algunas de estas sustancias se denominan elementales, ya que son moléculas constituidas con átomos idénticos, es decir, del mismo elemento (Peterson, 2013). Por ejemplo, el Oxígeno atmosférico está formado por 2 átomos de ese mismo elemento y se simboliza como O2. Otro tipo son las sustancias compuestas, estas son moléculas que se constituyen de átomos de distintos elementos (Peterson, 2013). Un ejemplo de este tipo de sustancias es el agua, ya que se halla formada por 2 átomos del Hidrógeno y 1 átomo de Oxígeno, y se simboliza como H2O.
Imagen extraída de: lifeder.com:elementos-quimicos-y-compuestos-quimicos-.
2.2. Compuestos Orgánicos y Compuestos Inorgánicos
Podemos clasificar a los compuestos químicos en orgánicos e inorgánicos. Los compuestos orgánicos son aquellos que, en su estructura química se halla al Carbono en combinación con Hidrógeno, Oxígeno, Nitrógeno o Azufre (Brown et al. 2004). Por ejemplo, la glucosa, un carbohidrato de gran importancia para el correcto funcionamiento de nuestro cuerpo, es un carbohidrato que posee una cadena de 6 átomos de Carbono que está en combinación con 12 átomos de Hidrógeno y 6 de Oxígeno: C6H12O6.
Mientras que dentro de los compuestos inorgánicos encontramos a todos los demás compuestos (Brown et al. 2004). Es decir, a aquellos cuya composición no gira en torno al carbono, sino que involucra otros elementos. Se forman por distintas reacciones y sus átomos y moléculas se unen mediante enlaces químicos (Raffino, 2010). Un ejemplo de compuesto inorgánico es el ácido clorhídrico, el cual lleva a cabo una función muy importante en el proceso de digestión de los alimentos que ingerimos. Esta sustancia está formada por 1 átomo de Hidrógeno y uno de Cloro y se simboliza como HCl. En este curso sólo nos abocaremos a trabajar en torno a los compuestos inorgánicos. Sin embargo, existen muchos compuestos que no encajan estrictamente en esta clasificación. Un ejemplo es el dióxido de carbono (CO2), un compuesto inorgánico típico pero que contiene carbono.
2.3. Fórmulas Químicas
Cada uno de los compuestos químicos posee una fórmula química y varias formas de nombrarlo, y eso es lo que veremos ahora.
Para entrar en tema, te proponemos que realices la lectura del texto extraído del libro “La química está entre nosotros, de qué están hechas las cosas (átomo a átomo y molécula a molécula)” de Julio Andrade Gamboa y Hugo Corso, de la colección Ciencia que Ladra.
Chino Básico
Manolito, uno de los amigos de Mafalda – la archifamosa tira de Quino – sacó un diez en Matemática por decir que “el orden de los factores no altera al producto”. No lo obtuvo por haber incorporado el conocimiento correspondiente a esa suerte de máxima, sino porque es vox pópuli.
¿Cuántas veces hemos escuchado afirmar, a gente que sería incapaz de decir “mi mamá me mima” en la lengua de Confucio, que “crisis”, en chino, significa “oportunidad”?
Estos son dos ejemplos de cosas que repetimos sin habernos cuestionado: a) si son ciertas, b) su significado conceptual o real.
Es así como un gran porcentaje de la población “sabe” que la fórmula química del agua es “H dos O” (o, más bien, “hachedosó), aunque sólo unos pocos pueden explicar lo que eso significa.
Tu nombre me sabe a hierba
Una fórmula química es una forma simbólica que expresa muchos conocimientos de manera condensada. La del agua (H2O) proporciona la misma información que la de cualquier otra sustancia, por ejemplo, de la de sacarosa o azúcar común (C12H22O11), y para “desplegar esa información” es necesario contar con algunos conocimientos previos:
-
- Qué es un átomo y qué es una molécula.
- Cuáles son y qué representan los símbolos químicos H, O y C.
- Qué se quiere indicar con los numeritos que aparecen en las fórmulas (2, 11, 12 y 22)
En el caso del agua, la información desplegada sería: “Cada molécula de agua está formada por dos átomos de hidrógeno y un átomo de oxígeno”.
Noten que si el subíndice (o número pequeño) no aparece a la derecha del símbolo químico, se sobreentiende que hay un átomo, como ocurre con el oxígeno en la fórmula del agua.
Para la sacarosa, aunque su fórmula sea más compleja, el tipo de información es exactamente el mismo: “Cada molécula de sacarosa está formada por doce átomos de carbono, veintidós átomos de hidrógeno y once átomos de oxígeno”. […] (Andrade Gamboa & Corso, 2012)
Concluyendo, podemos decir que los compuestos químicos se representan a través de fórmulas químicas. Además, como leíste, estas no son simples abreviaturas de los compuestos químicos, sino que aportan importante información cualitativa, es decir, qué elementos están presentes, y cuantitativa, cuántos átomos de cada elemento.
.
![]()
Para poner en práctica lo que estuviste leyendo sobre las fórmulas químicas, te proponemos que realices una actividad muy breve sobre este tema. Para acceder, haz CLIC AQUÍ.
Para hacerla te recomendamos que tengas la tabla periódica a mano.
2.4. Nomenclatura: Los nombres de los compuestos químicos
Como se mencionó con anterioridad, los compuestos químicos tienen una fórmula y un nombre (o varios). Estos son fundamentales para el vocabulario de la química, ya que, al conocerlos, podemos obtener información sobre una determinada sustancia. La nomenclatura química se encarga de asignar nombres a las sustancias (Brown et al. 2004).
A finales del siglo XVIII, con el pasaje de la alquimia a la química, las sustancias químicas comenzaron a recibir nombres lógicos y racionales propuestos por Lavoisier, Guyton de Morveau, Berthollet y Fourcony, posteriormente publicado en el Tratado Elemental de Química. En el siglo XIX, Berzelius asigna un símbolo a cada elemento; éste coincidía con la inicial del nombre del latín de dicho elemento. Así, las fórmulas de las sustancias químicas quedaron constituidas por una combinación de letras y números (Ramírez Vicente, 2010).
A continuación, se presenta un listado de los 50 elementos más comunes, con algunas notas sobre su origen etimológico. Muchos de ellos, como se mencionó anteriormente, provienen del latín, otros son producto de apreciaciones de los científicos que han hallado o descubierto dichos elementos y han perdurado, sean estas apreciaciones correctas o no. En muchos casos, el origen etimológico del nombre de los elementos no es una simple curiosidad cultural, sino que su raíz etimológica es utilizada para nombrar a los derivados del elemento (Peterson, 2013).


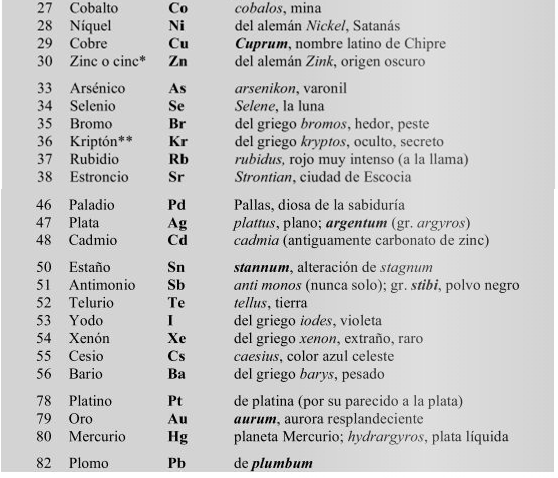
Este listado fue extraído de Peterson, 2013. Nomenclatura de las sustancias químicas. Editorial Reverté, 3° Edición; España.
En general, para nombrar a las sustancias, se sigue un conjunto sistemático de reglas basado en la composición de las mismas (Brown et al. 2004). De esta manera, se evita que una misma sustancia reciba distintos nombres en función a un criterio personal (Ramírez Vicente, 2010).
Actualmente, la IUPAC (Internacional Union of Pure and Applied Chemistry) es el organismo encargado de proponer reglas que sistematicen la nomenclatura de las sustancias químicas. Hay tres tipos de nomenclaturas: tradicional, de Stock y sistemática (Ramírez Vicente, 2010).
Tipos de nomenclatura
-
- Nomenclatura tradicional: El nombre de la sustancia está conformado por 2 palabras que indican el tipo de sustancia, los elementos que la conforman y su número de oxidación. Estos últimos se indican mediante prefijos (hipo – per) y sufijos (oso – ico). Ver Tabla 1.
Tal como los símbolos de los elementos provienen de sus nombres en latín, en este tipo de nomenclatura, ésto también se tiene presente para ciertos elementos.
|
Cantidad de N° de Oxidación |
Prefijo |
Sufijo |
Se utiliza para… |
|
Uno |
- |
- |
* |
|
Dos |
- |
oso ico |
Menor n° de oxidación Mayor n° de oxidación |
|
Tres |
Hipo |
oso oso ico |
Menor n° de oxidación N° de oxidación medio Mayor n° de oxidación |
|
Cuatro |
Hipo
Per |
oso oso ico ico |
Menor n° de oxidación N° de oxidación medio N° de oxidación medio Mayor n° de oxidación |
Tabla 1. Sobre la cantidad de n° de oxidación, prefijos y sufijos y su uso.
Por ejemplo, el óxido férrico es una sustancia formada por oxígeno y hierro. El término óxido hace referencia, justamente a que se trata de una combinación de algún elemento con oxígeno. El término férrico se refiere a dos cuestiones: 1. El elemento en cuestión es el Hierro y 2. El Hierro posee 2 números de oxidación y está trabajando con el mayor de ellos. Su fórmula química es Fe2O3, lo que indica que está formado por 2 átomos de hierro y 3 átomos de Oxígeno.
* Cuando el elemento tiene sólo 1 n° de oxidación, la sustancia se nombra con el tipo de compuesto y el nombre del elemento. Por ejemplo, el Calcio, tiene sólo 1 n° de oxidación y al combinarse con el Oxígeno forma el Óxido de Calcio.
-
-
Nomenclatura de Stock: En esta nomenclatura, las sustancias se nombran indicando el tipo de sustancia y el número de oxidación utilizado por el elemento en números romanos. El nombre de la sustancia quedaría expresado de manera genérica como:

-
Si volvemos al ejemplo con el Hierro, el nombre del compuesto sería: Óxido de Hierro (III).
-
- Nomenclatura sistemática: En este tipo de nomenclatura, las sustancias se nombran teniendo en cuenta el tipo de sustancia y las cantidades en las que se hallan los elementos; estos últimos se indican a través de prefijos. Ver Tabla 2.
|
Cantidad de átomos |
Prefijo |
|
1 |
Mono |
|
2 |
Di |
|
3 |
Tri |
|
4 |
Tetra |
|
5 |
Penta |
|
… |
… |
Tabla 2. Cantidad de átomos que forman la sustancia y prefijos.
El nombre de la sustancia quedaría expresado de manera genérica como:

Por ejemplo, el Fe2O3, se nombraría Trióxido de dihierro.
En la siguiente tabla se comparan los 3 tipos de nomenclatura con el ejemplo del Fe2O3. Ver Tabla 3.
|
Tradicional |
Stock |
Sistemática |
|
|
Fe2O3 |
Oxido férrico |
Óxido de hierro (III) |
Trióxido de di-hierro |
Tabla 3. Comparación de los tipos de nomenclatura para el Fe2O3.
Si bien, se mencionan varios conceptos que aún no hemos visto en este libro, es importante que los tengas presentes ya que se desarrollarán en secciones posteriores. Así también, aunque se presentan los 3 tipos de nomenclatura, en este libro nos centraremos en utilizar la nomenclatura tradicional.
.
![]()
Ahora te proponemos que realices una actividad en la que podrás aplicar los conceptos leídos. Para acceder haz CLIC AQUÍ.
2.5. Ecuaciones Químicas
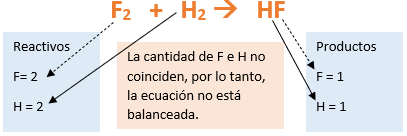
Las sustancias químicas se forman a través de reacciones químicas y éstas se representan mediante ecuaciones químicas. En una ecuación química se observan las sustancias que reaccionan (reactivos) y las sustancias que se obtienen (productos). Además, se indican las cantidades relativas de las sustancias involucradas y sus estados de agregación (Cabanne y Fernández, 2014). Ver Imagen 1.
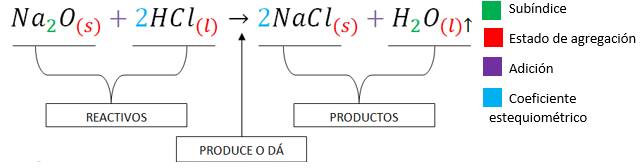
Imagen 1. Extraída de: Cabanne, Daniela; Fernández, Andrea. (2014). "Capítulo III: Formulación de compuestos inorgánicos. Nomenclatura". Cuadernillo de Nivelación en Química. Facultad de Ciencias Forestales. UNaM.
Ejemplo: Cuando el hidrógeno arde, reacciona con el oxígeno del aire para producir agua. Esta reacción se puede representar de la siguiente manera:
H2 + O2 --> H2O
Importante: Los elementos que, en la tabla periódica pueden identificarse como gases (H, N, O, F, Cl), en su estado natural se encuentran como moléculas diatómicas, es decir, que están formadas por dos átomos del elemento. Por lo tanto, cuando escribimos a alguno de estos elementos en las ecuaciones de formación colocamos, debajo del símbolo del elemento, como subíndice un “2”. Ejemplo: H2.
Para balancear esta ecuación debemos tener en cuenta la cantidad de átomos de cada elemento que tenemos a cada lado de la reacción. Si la observamos, podemos notar que, tanto el oxígeno como el hidrógeno son elementos diatómicos, por lo tanto, del lado de los reactivos tenemos 2 átomos de Hidrógeno (H2) y 2 átomos de Oxígeno (O2). Mientras que, del lado de los productos tenemos 2 átomos de Hidrógeno y 1 átomo de Oxígeno.
Para igualar las cantidades de átomos, utilizamos coeficientes estequiométricos, los cuales se ubican delante de la fórmula química de los reactivos y/o de los productos según sea el caso. Cuando el coeficiente es igual a 1, no se escribe.
Para nuestro ejemplo:
H2 + O2 --> H2O
Como tenemos 2 átomos de Oxígeno del lado de los reactivos y sólo 1 en el producto, colocamos como coeficiente estequiométrico el número 2, delante de la fórmula química del producto:
H2 + O2 --> 2 H2O
El coeficiente estequiométrico multiplica la cantidad de átomos que tenemos de cada elemento en esa molécula. Es decir, como teníamos…
1 átomo de Oxígeno = 1 Oxígeno x 2= 2 Oxígeno
2 átomos de Hidrógeno = 2 Hidrógeno x 1= 2 Hidrógeno
Por lo tanto, ahora tenemos 2 átomos de Hidrógeno y 2 átomos de Oxígeno en los reactivos, mientras que en los productos tenemos 4 átomos de Hidrógeno y 2 de Oxígeno.
Posteriormente, colocamos un coeficiente estequiométrico de valor 2 delante del Hidrógeno que se halla en el lado de los reactivos:
2 H2 + O2 --> 2 H2O
.

.Te proponemos que realices una actividad en la que podrás repasar y aplicar los conceptos desarrollados. Para acceder haz CLIC AQUÍ.
2.6. Número de Oxidación
Hasta ahora, vimos algunos conceptos que son básicos para la formulación de compuestos inorgánicos. Otro concepto que es igual de importante y que fue nombrado varias veces es el de número de oxidación. El número o estado de oxidación de un elemento en un compuesto es un número entero (positivo o negativo) que representa el número de electrones que un átomo de ese elemento cede o gana o tiende a compartir cuando se combina con otro átomo. El número de oxidación es positivo cuando el elemento cede o tiende a ceder electrones, mientras que es negativo si gana o tiende a ganar electrones. El número de oxidación de cada elemento puede encontrarse en la tabla periódica.
2.6.1 Reglas para asignar números de oxidación
- El número de oxidación de un elemento en una sustancia simple o elemento siempre es cero. Ej.: Fe, Zn, O2.
- En los compuestos, la suma algebraica de los números de oxidación de los elementos involucrados, multiplicados por sus respectivas atomicidades, es igual a cero.
- El número de oxidación de un ion sencillo (monoatómico) es igual a la carga del ion.
- Para iones poliatómicos (formados por dos o más átomos), la suma algebraica de los números de oxidación de los elementos involucrados, multiplicados por sus respectivas atomicidades, es igual a la carga neta del ion.
- El hidrógeno presenta habitualmente número de oxidación +1 (excepción en los hidruros metálicos = -1. Ejemplo de esta excepción: NaH y CaH2)
- De ordinario, el número de oxidación del oxígeno es -2, a excepción en los peróxidos donde trabaja con nº de oxidación -1. (H2O2)
- Todos los elementos del grupo IA de la Tabla Periódica presentan número de oxidación +1.
- Todos los elementos del grupo IIA de la TP. presentan número de oxidación +2.
- El Flúor siempre presenta número de oxidación -1.
A continuación, se presenta una tabla con los números de oxidación más frecuentes. La misma fue extraída y adaptada de Peterson, 2013. Nomenclatura de las sustancias químicas. Editorial Reverté, 3° Edición; España. Tabla 4.
|
Grupo |
Elemento |
Número de Oxidación |
|
Grupo 1 |
H |
I, -I |
|
Grupo 2 |
Be |
II |
|
Grupo 3 |
Sc |
III |
|
Grupo 4 |
Ti |
II, III, IV |
|
Grupo 5 |
V |
II, III, IV, V |
|
Grupo 6 |
Cr |
II, III, VI |
|
Grupo 7 |
Mn |
II, III, IV, VII |
|
Grupo 8 |
Fe |
II, III |
|
Grupo 9 |
Co |
II, III |
|
Grupo 10 |
Ni |
II, III |
|
Grupo 11 |
Cu |
I, II |
|
Grupo12 |
Zn |
II |
|
Grupo 13 |
B |
III, -III |
|
Grupo 14 |
C |
IV, -IV |
|
Grupo 15 |
N |
II, III, IV, V, -III |
|
Grupo 16 |
O |
-II |
|
Grupo 17 |
F |
-I |
Tabla 4. Números de oxidación más frecuentes.
2.6.2 Cálculo del número de oxidación
Cuando comenzamos a formular compuestos es importante tener presentes las reglas para asignar números de oxidación. Para ver la aplicación de algunas de estas reglas, te proponemos que leas el siguiente ejemplo:
Consigna: Indica los números de oxidación de cada elemento en el siguiente compuesto: HClO3. Paso 1: En primer lugar, debemos leer nuevamente las reglas para asignar números de oxidación. Paso 2: Teniendo en cuenta las reglas 5 y 6, podemos saber que en este compuesto el hidrógeno, H, posee n° de oxidación +1 y el oxígeno, O, -2. H= +1 O= -2 Cl= ¿? -> X Paso 3: A partir de que conocemos los n° de oxidación de 2 de los elementos presentes y teniendo en cuenta la regla 2, podemos plantear la siguiente ecuación: 1 + X + 3(-2) = 0 Si observamos la Fórmula Química, en este compuesto hay 3 átomos de oxígeno, por lo que el n° de oxidación se multiplica por la cantidad de átomos. Paso 4: A continuación, debemos despejar X de la ecuación anterior. 1 + X + 3(-2) = 0 1 + X -6 = 0 1 + X = 0 + 6 X = 6 – 1 X= 5 . Para repasar lo que leíste, te proponemos que observes y tomes nota del siguiente video tutorial. Te recomendamos que pauses el video y resuelvas en una hoja los ejercicios que se presentan. Autor: Holzmaisters Jonathan. Te proponemos que realices una actividad para aplicar las reglas para asignar los números de oxidación. Para acceder haz CLIC AQUÍ.Veamos un ejercicio tipo resuelto


2.7. Clasificación de los Compuestos Inorgánicos
Podemos clasificar a las sustancias inorgánicas en función a dos criterios generales:
-
- Los tipos de elementos que se combinan.
- El número de átomos diferentes que forman el compuesto: binarios (dos átomos diferentes), ternarios (tres átomos diferentes), cuaternarios (cuatro átomos diferentes).
A continuación, se presenta una tabla semejante a la que puedes encontrar detrás de tu tabla periódica: (Tabla 5)
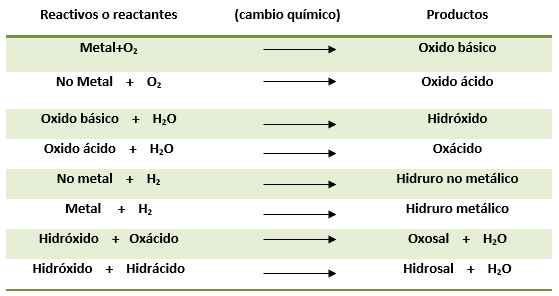
Tabla 5. Tipos de compuestos. Cabanne y Fernández (2014). En esta tabla se hallan, en la columna de la izquierda los reactivos, en la columna del medio, la flecha que indica "reacción" y en la columna derecha, los productos. En ella se resumen los distintos tipos de compuestos que pueden formarse en función a los reactivos involucrados; por ejemplo, cuando se combinan un elemento metálico con oxígeno, se forma un óxido básico. En el capítulo siguiente encontrarás algunos de estos tipos de compuestos explicados en mayor detalle.
En resumen...
En este capítulo pudiste leer que los compuestos químicos son sustancias formadas por 2 o más átomos que se unen en proporciones definidas, que los átomos que forman las sustancias pueden ser del mismo elemento -sustancia elemental- o de elementos diferentes -sustancia compuesta- y que podemos clasificar, de manera muy general, a los compuestos en orgánicos e inorgánicos. Por otro lado, viste que los compuestos se forman mediante reacciones químicas, se representan utilizando fórmulas químicas, que se nombran a través de una serie de indicaciones establecidas por la IUPAC y está relacionado con el número de oxidación que utilizan los elementos a la hora de combinarse. Finalmente, leíste que los compuestos inorgánicos pueden clasificarse en función al tipo de elementos que se combinan y al número diferente de átomos que se hallan en la fórmula química de los compuestos.
3. COMBINACIONES BINARIAS
 En este capítulos trabajarás en torno a los compuestos binarios, es decir, aquellos formados por átomos de dos elementos diferentes. En primer lugar, te presentamos a las combinaciones binarias con hidrógeno, dicho en otras palabras, aquellos compuestos que se forman a través de la reacción de un elemento de la tabla periódico con el hidrógeno; estos compuestos se conocen como hidruros. También verás que un tipo de hidruro, los "no metálicos" pueden disolverse en agua para dar lugar a los hidrácidos.
En este capítulos trabajarás en torno a los compuestos binarios, es decir, aquellos formados por átomos de dos elementos diferentes. En primer lugar, te presentamos a las combinaciones binarias con hidrógeno, dicho en otras palabras, aquellos compuestos que se forman a través de la reacción de un elemento de la tabla periódico con el hidrógeno; estos compuestos se conocen como hidruros. También verás que un tipo de hidruro, los "no metálicos" pueden disolverse en agua para dar lugar a los hidrácidos.
Por otro lado, te presentamos a las combinaciones binarias con oxígeno, es decir, aquellos compuestos que se forman por la reacción de un elemento de la tabla periódico con el oxígeno; estos compuestos se conocen como óxidos.
Imagen extraída de: https://www.idibujos.com/wp-content/uploads/2012/04/Leer-470x260.jpg
3.1. Combinaciones Binarias con Hidrógeno
Para comenzar a pensar en las combinaciones binarias con el hidrógeno, te proponemos que leas el siguiente fragmento del texto “El Hidrógeno” del sitio web: TextosCientificos.com.
Este elemento tiene una química singular. Además, sus tres isótopos difieren tanto en sus masas moleculares que las propiedades físicas y químicas son sensiblemente diferentes. La primera referencia histórica escrita acerca del hidrógeno procede de Paracelso, célebre alquimista, quien en el s. XVI observó un aire (que se desprendía al hacer reaccionar un ácido sobre hierro) el cual era inflamable. Robert Boyle (1627-1691), químico y físico inglés, publicó en 1671 un trabajo titulado New experiments touching the relation betwixt flame and air flame and air en el cual describía la reacción entre el hierro y algunos ácidos diluidos dando lugar a lo que definió como inflammable solution of Mars solution of Mars (nombre alquímico con el que se designaba al hierro). Sin embargo, no fue hasta mucho después que se reconoció como elemento por Henry Cavendish (1731-1810), otro físico y químico inglés, que lo aisló, recogiéndolo sobre mercurio, por primera vez en 1766. Lo describió como un inflammable air from metals. Cavendish pensaba, erróneamente, que su compuesto de origen era el metal y no el ácido. Fue Lavoisier quien, finalmente, bautizó a este elemento con el nombre hidrogeno, debido a una de sus reacciones más características: arde en presencia de oxígeno para formar agua. Presencia en la naturaleza: El hidrógeno es el elemento más abundante del Universo. Representa, en peso, el 92% de la materia conocida; del resto, un 7% es de He y solamente queda un 1% para los demás elementos. En nuestro planeta es el 10º elemento más abundante en la corteza terrestre. Lo encontramos combinado en forma de agua (su compuesto más abundante; cubre el 80% de la superficie del planeta), materia viva (hidratos de carbono y proteínas; constituye el 70% del cuerpo humano), compuestos orgánicos, combustibles fósiles (petróleo y gas natural), etc. Curiosamente, es poco abundante en la atmósfera terrestre debido a que su reducida masa molecular hace difícil su retención gravitatoria. Excepto en la estratosfera, donde se puede detectar en forma atómica, el hidrógeno elemental se presenta siempre en forma molecular H2 molécula a la que denominaremos dihidrógeno, como recomiendan algunos autores, hidrógeno molecular o simplemente hidrógeno. El dihidrógeno (H2) es un gas incoloro e inodoro, menos denso que cualquier otro gas (d=8.99·10-5 g/cm3) y muy poco soluble en agua. El hidrógeno es el sistema de almacenamiento de energía por excelencia en el universo. Las estrellas relativamente jóvenes como nuestro Sol, están compuestas mayoritariamente por hidrógeno y se sustentan a sí mismas mediante reacciones químicas. (Textos.Cientificos.com, 2006)
El hidrógeno al combinarse con otros elementos, forma sustancias con propiedades muy diferentes. Algunos de estos compuestos son:
-
- Los hidruros: compuestos formados por cualquier elemento e Hidrógeno, pueden ser:
- Hidruros Metálicos: se forman por la combinación del hidrógeno con elementos mucho menos electronegativos que él. Un caso especial son los hidruros que se forman con los metales de transición (Peterson, 2013).
Son compuestos binarios constituidos por un elemento metálico y el hidrógeno. En estos hidruros, el hidrógeno siempre trabaja con n° de oxidación -1.
Se obtienen de acuerdo con la siguiente ecuación general:
Metal + H2 --> Hidruro metálico
Ejemplo: Ca + H2 --> CaH2
Fórmula Química: Queda determinada por el metal y el hidrógeno, cuyas valencias o números de oxidación se intercambian y se anotan como subíndices; se escribe a la izquierda el metal (por ser el más electropositivo) y el hidrógeno, a la derecha (por ser el menos electropositivo).
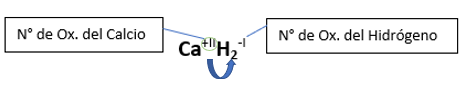
En la fórmula de un compuesto la suma de los números de oxidación entre los elementos debe ser cero. Lo que significa que la molécula será neutra y sin carga, a menos que la fórmula indique lo contrario, con una carga positiva o negativa como en el caso de los iones.
Nomenclatura:
Según la nomenclatura tradicional:
➡️ Si el metal con el que se combina el hidrógeno tiene una sola valencia, se nombra con las palabras Hidruro de..., y el nombre del metal con el que se combina. Ejemplo: CaH2; Hidruro de Calcio.
➡️ Si el metal con el que se combina al hidrógeno tiene dos valencias se utilizan los sufijos “oso” e “ico” y se suprime la sílaba “de”:
⏺️“oso” cuando el elemento usa la menor valencia; Ejemplo: FeH2, valencia del hierro (II): Hidruro ferroso.
⏺️“ico” cuando el elemento va con la mayor valencia; Ejemplo: FeH3, valencia del hierro (III): Hidruro férrico.
Ahora te proponemos que leas con atención el siguiente tutorial paso a paso para formular un Hidruro Metálico.
Tutorial paso a paso 1: Formación de un hidruro metálico a partir de su nombre
En este tutorial plantearemos la ecuación de formación de un hidruro metálico, con el objetivo de obtener su fórmula química, usando como referencia el nombre que obtiene por nomenclatura tradicional.
Vamos paso a paso:
Paso 1: En primer lugar, debemos conocer el nombre del compuesto y a partir del mismo, y junto a las reglas de nomenclatura, poder extraer la información necesaria:
Paso 2: Escribimos las fórmulas de los reactivos, en este caso hidrógeno (recuerda que el hidrógeno se presenta en la naturaleza como moléculas diatómicas; por lo tanto se escribe: H2) y hierro (Fe), separados por un signo + (no importa el orden de los reactivos, puede escribirse el H2 o el Fe primero y luego el otro):
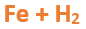
Paso 3: Luego de los reactivos agregamos la flecha de reacción (-->) que además de indicar que se da una reacción química, separa los reactivos de los productos:

Paso 4: Empezamos a platear la formula del hidruro metálico, para ello escribimos el símbolo del metal (Fe) seguido del símbolo del hidrógeno (sin separarlos con un +), después de la flecha de reacción:
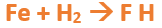
Paso 5: En la tabla periódica buscamos los números de oxidación de cada elemento:

Paso 6: Teniendo en cuenta el nombre del compuesto seleccionamos el número de oxidación correspondiente para cada elemento: El H utilizará el -1, por ser un hidruro metálico y el Fe el +3 (mayor), ya que el nombre termina en “ico”.
Paso 7: Escribimos en lápiz los valores seleccionados anteriormente en números romanos sobre cada elemento (este paso es opcional):
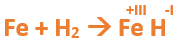
Paso 8: Escribimos el número de oxidación del hidrógeno como subíndice del hierro y viceversa, luego borramos los números de oxidación que escribimos en lápiz:
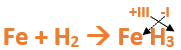
Importante: no se debe escribir 1 como subíndice debido a que el símbolo del elemento ya representa a un átomo o mol de átomos de este.
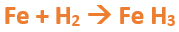
Paso 9: Revisamos si la ecuación esta balanceada, para ello debemos verificar si cada elemento aparece la misma cantidad de veces en reactivos y en productos (Es importante recordar que los subíndices indican la cantidad de átomos de un elemento):
Paso 10: Finalmente, si la ecuación no se encuentra balanceada, es preciso realizar esta operación. Para ello es necesario agregar coeficientes estequiométricos (éstos, son números enteros, generalmente pequeños, que se agregan frente a las fórmulas químicas de los compuestos y multiplican a cada elemento de la misma). En este caso se debe agregar un 2 delante del FeH3 en los productos y un 3 delante del H2 para que coincida la cantidad de hidrógeno, y luego se debe agregar un 2 frente al Fe en reactivos para que la cantidad de hierro coincida:
-
- Y de esta manera obtenemos la ecuación balanceada del hidruro férrico.
Autor: Holzmaisters Jonathan.
![]()
Para repasar lo que leíste, te proponemos que observes y tomes nota del siguiente video tutorial. Te recomendamos que a medida que avanza la explicación, pauses el video y resuelvas los ejercicios propuestos. Autor: Holzmaisters Jonathan.
____________________________________________________________________________________________________________________________________________
- Hidruros No Metálicos: Son compuestos binarios constituidos por un elemento Halógeno (F, Cl, Br, I) o Anfígeno (S, Se, Te), los cuales actúan con números de oxidación -1 y -2 respectivamente) y el hidrógeno. En estos hidruros, el no metal siempre utiliza su menor valencia negativa, mientras que el hidrógeno siempre trabaja con n° de oxidación +1. Se obtienen mediante la siguiente ecuación general:
No Metal + H2 --> Hidruro no metálico
Ejemplo: S + H2 --> H2S
Fórmula Química: Queda determinada por el no metal y el hidrógeno, cuyas valencias o números de oxidación se intercambian y se anotan como subíndices; se escribe a la izquierda el hidrógeno (por ser el más electropositivo) y el no metal a la derecha (por ser el menos electropositivo).
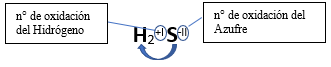
Nomenclatura:
Según la nomenclatura tradicional:
➡️ Se nombran utilizando el sufijo “uro” en el no metal y las palabras “…de hidrógeno.” Ejemplo: H2S; Sulfuro de Hidrógeno.
Ahora te proponemos que leas con atención el siguiente tutorial paso a paso para formular un Hidruro No Metálico.
Vamos paso a paso: Paso 1: En primer lugar, debemos conocer el nombre del compuesto y a partir del mismo, y junto a las reglas de nomenclatura, poder extraer la información necesaria: Paso 2: Escribimos las fórmulas de los reactivos, en este caso hidrógeno (H2) y Bromo (Br2), separados por un signo + (no importa el orden de los reactivos, puede escribirse el H2 o el Br2 primero y luego el otro): Paso 3: Luego agregamos la flecha de reacción (-->) para separar los reactivos de los productos: Paso 4: Empezamos a platear la fórmula del hidruro no metálico, para ello escribimos el símbolo del hidrógeno seguido del símbolo del no metal [Br] (sin separarlos con un +), después de la flecha de reacción: Paso 5: En la tabla periódica buscamos los números de oxidación de cada elemento: Paso 6: Teniendo en cuenta el nombre del compuesto, seleccionamos el número de oxidación correspondiente para cada elemento: El H utilizará el +1, y el Br el -1, ya que es un hidruro no metálico (usa su menor número de oxidación negativo). Paso 7: Escribimos en lápiz los valores seleccionados anteriormente en números romanos sobre cada elemento (este paso es opcional): Paso 8: El número de oxidación del hidrógeno pasa como subíndice del bromo y viceversa, luego borramos los números de oxidación que escribimos en lápiz: Importante: no se debe escribir 1 como subíndice debido a que el símbolo del elemento ya representa a un átomo o mol de átomos de este. Paso 9: Revisamos si la ecuación esta balanceada, para ello debemos verificar si cada elemento aparece la misma cantidad de veces en reactivos y en productos: Paso 10: Finalmente, si la ecuación no se encuentra balanceada, es preciso realizar esta operación. Para ello es necesario agregar coeficientes estequiométricos tal como se explicó en el tutorial anterior. En este caso se debe agregar un 2 delante del HBr en productos, para que coincida la cantidad de hidrógeno y de bromo. Autor: Holzmaisters Jonathan.Tutorial paso a paso 2: Formación de un hidruro no metálico a partir de su nombre
En este tutorial plantearemos la ecuación de formación de un hidruro no metálico, con el objetivo de obtener su fórmula química, usando como referencia el nombre que obtiene por nomenclatura tradicional.


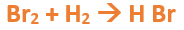

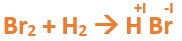
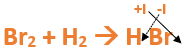
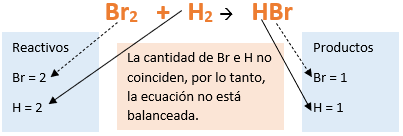

Para repasar lo que leíste, te proponemos que observes y tomes nota del siguiente video tutorial. Autor: Holzmaisters Jonathan.
Fluoruro de Hidrógeno: Bromuro de Hidrógeno: Yoduro de Hidrógeno: El yoduro de hidrógeno es muy utilizado en la síntesis de compuestos tanto orgánicos como inorgánicos del yodo. Además, es utilizado como desinfectante y también forma parte de algunos suplementos _____________________________________________________________________________________________________________________________________________ Recordemos que los hidruros no metálicos se hallan, generalmente, en estado gaseoso a temperatura ambiente. Por otro lado, la mayoría de estos llevan a cabo múltiples funciones en disolución acuosa. Los hidrácidos, al igual que los hidruros no metálicos, son compuestos formados por Hidrógeno y un elemento no metálico que puede ser un Halógeno o un Anfígeno. La diferencia entre estos es que, un hidrácido se obtiene por la dilución en solución acuosa de un hidruro no metálico. Esto, se puede representar de la siguiente manera: Fórmula Química: Permanece igual, indicando el estado en el que se encuentra si es que éste varía. Nomenclatura: Según la nomenclatura tradicional: ➡️ En lugar de la palabra hidruro se utiliza la palabra ácido y al elemento no metálico se le agrega el sufijo “hídrico”. Ejemplo: Ácido sulfhídrico. Ahora te proponemos que leas con atención el siguiente tutorial paso a paso para formular un Hidrácido. En este tutorial plantearemos la ecuación de formación de un hidrácido, con el objetivo de obtener su fórmula, usando como referencia el nombre que obtiene por nomenclatura tradicional. Vamos paso a paso: Paso 1: En primer lugar, debemos conocer el nombre del compuesto y a partir del mismo, y junto a las reglas de nomenclatura, poder extraer la información necesaria: Importante: como existen 2 tipos de ácidos es necesario saber cómo diferenciarlos: Nota: para fines prácticos, en hidrácidos se emplea tanto la ecuación de formación como la formula general de hidruros no metálicos, lo único que cambia es la nomenclatura. Esto se debe a que los hidruros no metálicos y los hidrácidos presentan la misma fórmula química. Recuerda que para diferenciar a los hidruros no metálicos de los hidrácidos, a estos últimos le agregamos la sigla “aq” (que significa "en solución acuosa") entre paréntesis [(aq)] luego de la formula. Ejemplo:
Paso 2: Escribimos las fórmulas de los reactivos, en este caso hidrógeno (H2) y flúor (F2), separados por un signo + (no importa el orden de los reactivos, puede escribirse el H2 o el F2 primero): Paso 3: Luego de los reactivos agregamos la flecha de reacción (-->): Paso 4: Empezamos a platear la formula del hidrácido, para ello escribimos el símbolo del hidrógeno seguido del símbolo del no metal (F) (sin separarlos con +), después de la flecha de reacción: Paso 5: En la tabla periódica buscamos los números de oxidación de cada elemento: Paso 6: Teniendo en cuenta el nombre del compuesto seleccionamos el número de oxidación correspondiente para cada elemento: El H utilizará el +1, y el F el -1, ya que es un hidrácido. Paso 7: Escribimos en lápiz los valores seleccionados anteriormente en números romanos sobre cada elemento (este paso es opcional): Paso 8: El número de oxidación del hidrógeno pasa como subíndice del flúor y viceversa, luego borramos los números de oxidación que escribimos en lápiz: Paso 9: Revisamos si la ecuación esta balanceada, para ello debemos verificar si cada elemento aparece la misma cantidad de veces en reactivos y en productos: Paso 10: Finalmente, si la ecuación no se encuentra balanceada, es preciso realizar esta operación. Para ello es necesario agregar coeficientes estequiométricos. En este caso se debe agregar un 2 delante del HF en productos, para que coincida la cantidad de hidrógeno y de flúor. Autor: Holzmaisters Jonathan. . .Te proponemos que realices una actividad de repaso sobre las combinaciones binarias con hidrógeno. Para acceder haz CLIC AQUÍ.
Se trata de un gas incoloro y corrosivo. Es una materia prima industrial que se utiliza en la fabricación de refrigerantes, herbicidas, productos farmacéuticos, gasolina, productos de acero inoxidable para la cocina, aluminio, plástico, componentes eléctricos y focos incandescentes. El 60% del fluoruro de hidrógeno utilizado en procesos industriales, se destina a la refrigeración, congeladores y sistemas de aire acondicionado. Fuente: ChemicalSafetyFacrs.or: Flúor de Hidrógeno en: https://www.chemicalsafetyfacts.org/es/hydrogen-fluoride/
Es un gas incoloro de olor fuerte e irritante y puede encontrarse como gas comprimido o en solución. Se utiliza para la elaboración de sustancias químicas y fármacos, también como catalizador y para disolver aceites. Fuente: Derecho a
saber. Hoja Informativa sobre sustancias peligrosas: https://nj.gov/health/eoh/rtkweb/documents/fs/1011sp.pdf
dietarios. Por otra parte, es utilizado en la fabricación de tinturas de yodo. EcuRed: Ácido Yodhídrico. En: https://www.ecured.cu/%C3%81cido_yodh%C3%ADdrico
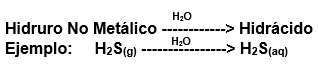
Tutorial paso a paso 3: Formación de un hidrácido a partir de su nombre


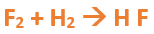

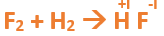
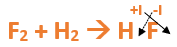

3.2. Combinaciones Binarias con Oxígeno
Las combinaciones binarias con Oxígeno son comúnmente llamadas Óxidos. En general, los óxidos están formados por oxígeno y cualquiera de los restantes elementos de la tabla periódica. Excepto por el Flúor que, al ser más electronegativo que el oxígeno, en realidad forma el fluoruro de oxígeno y el Hidrógeno, ya explicado anteriormente. (Peterson, 2013).
Antes de comenzar a trabajar en los tipos de óxidos, te proponemos que realices la lectura del texto “Oxígeno” de Garrido y Bianchi, publicado en “El gato y la Caja”.
 Hubo una época en la que nadie podía decir de qué estaba formado el aire que los rodeaba, el agua que bebían, los alimentos que consumían o, incluso, sus propios cuerpos. Diferentes teorías intentaron explicar qué era el gas vital, ese que mantenía vivos a los animales, o qué componente tenían los materiales inflamables, como la madera (al que llamaban flogisto). Lejos estaban de conocer que había un compuesto común entre todas esas situaciones.
Hubo una época en la que nadie podía decir de qué estaba formado el aire que los rodeaba, el agua que bebían, los alimentos que consumían o, incluso, sus propios cuerpos. Diferentes teorías intentaron explicar qué era el gas vital, ese que mantenía vivos a los animales, o qué componente tenían los materiales inflamables, como la madera (al que llamaban flogisto). Lejos estaban de conocer que había un compuesto común entre todas esas situaciones.
Obvio que hoy, con el diario del lunes, las ideas que se planteaban podrían parecernos delirantes. Todos sabemos que ese gas que está en la atmósfera y nos permite obtener energía al respirar es el mismo que permite la combustión. Pero, ¿acaso en un tiempo no nos van a parecer delirantes las teorías que hacemos hoy sobre cosas que desconocemos, como la forma en la que la conciencia emerge del cerebro, o por qué no existen los dobles de miga?
A fines de 1700, Antoine Lavoisier y Marie Anne Pierrette Paulze no paraban de hacer experimentos prendiendo fuego cosas en ambientes cerrados. Lo que notaban era que había algo involucrado en ese proceso de combustión que no estaban viendo y que debía estar en el aire. Así fue como, entre otras cosas (incluidas tomar prestadas sin pedir permiso algunas ideas de un tal Joseph Priestley) bautizaron el oxígeno.
Claro que la cuestión no quedó ahí. A principios de 1800, Dalton propuso las bases de la teoría atómica, en la cual planteaba que cada elemento conocido estaba formado por un solo tipo de átomos, pero a su vez, distintos elementos podían combinarse entre sí, formando compuestos químicos. De esta forma, por ejemplo, el oxígeno se iba a combinar con el hidrógeno para formar el agua.
Como a toda buena historia, le falta una separación dramática. Fue Avogadro (uno que inventó una unidad de medir cantidades y tuvo la original idea de ponerle su nombre) quien vino a decirnos que en realidad existen distintas maneras en las que podemos encontrar el oxígeno: el gas oxígeno está formado únicamente por el átomo oxígeno, pero en realidad, hay dos átomos de oxígeno que pueden ser separados.
Para los que crean que Messi −Suarez − Neymar fue el mejor tridente de la historia: Lavoisier − Dalton − Avogadro pueden no haber ganado tanta plata ni partidos en tan poco tiempo, pero tienen buenos números.
El oxígeno está en todas partes. Tal vez por eso sea imposible contar su historia: habría que contar la historia del Universo y la del mundo, la historia de la vida y la historia de la historia que se está contando, y la historia del que escribe la historia y la del que la está leyendo y así, hasta quedarnos sin aire. (Garrido & Bianchi)
-
- Óxidos Básicos: Son compuestos binarios constituidos por un elemento metálico y Oxígeno, donde este último siempre trabaja con número de oxidación -2.
Se obtienen de acuerdo con la siguiente ecuación general:
Metal + O2 --> Óxido básico
Ejemplo: 2Fe + O2 --> 2FeO
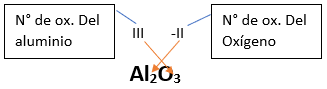
Fórmula Química: Queda determinada por el metal y el oxígeno, cuyas valencias o números de oxidación se intercambian y se anotan como subíndices.
En el caso de que sean múltiplos, se simplifican; por ejemplo:
Fe2O2 --> FeO
Nomenclatura:
Según la nomenclatura tradicional:
➡️ Si el metal con el que se combina el oxígeno tiene una sola valencia, se nombra con las palabras Óxido de..., y el nombre del metal con el que se combina. Ejemplo: Al2O3; Óxido de Aluminio.
➡️Si el metal con el que se combina al oxígeno tiene dos valencias se utilizan los sufijos “oso” e “ico” y se suprime la sílaba “de”:
⏺️ “oso” cuando el elemento usa la menor valencia; Ejemplo: FeO, valencia del hierro (II): Óxido ferroso
⏺️ “ico” cuando el elemento va con la mayor valencia; Ejemplo: Fe2O3, valencia del hierro (III): Óxido férrico.
Ahora te proponemos que leas con atención el siguiente tutorial paso a paso para formular un Óxido Básico.
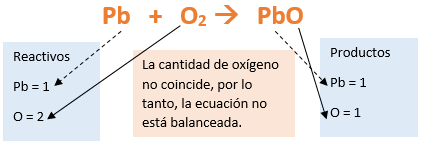
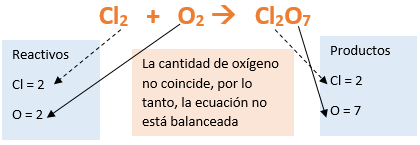
En este tutorial plantearemos la ecuación de formación de un oxido básico, con el objetivo de obtener su fórmula, usando como referencia el nombre que obtiene por nomenclatura tradicional. Vamos paso a paso: Paso 1: En primer lugar, debemos conocer el nombre del compuesto y a partir del mismo, y junto a las reglas de nomenclatura, extraer la información necesaria: Paso 2: Escribimos las fórmulas de los reactivos, en este caso, oxígeno (O2) y plomo (Pb), separados por un signo + (no importa el orden de los reactivos, puede escribirse el O2 o el Pb primero y luego el otro): Paso 3: Luego de los reactivos agregamos la flecha de reacción (-->): Paso 4: Empezamos a platear la fórmula del óxido, para ello escribimos el símbolo del metal (Pb) seguido del símbolo del oxígeno (sin separarlos con +), después de la flecha de reacción: Paso 5: En la tabla periódica buscamos los números de oxidación de cada elemento: Paso 6: Teniendo en cuenta el nombre del compuesto seleccionamos el número de oxidación o valencia correspondiente para cada elemento: El O utilizará el -2 y el Pb el +2 (menor), ya que el nombre termina en “oso”. Paso 7: Escribimos en lápiz los valores seleccionados anteriormente en números romanos sobre cada elemento (este paso es opcional): Paso 8: Escribimos el número de oxidación del oxígeno como subíndice del plomo y viceversa, luego borramos los números de oxidación que escribimos en lápiz: Importante: siempre que, en un compuesto todos los subíndices sean múltiplos entre sí, es necesario simplificarlos, para obtener la formula más sencilla del óxido. En este caso debemos dividir ambos subíndices por 2, quedando de la siguiente manera: Paso 9: Revisamos si la ecuación esta balanceada, para ello debemos verificar que cada elemento aparezca la misma cantidad de veces en reactivos y en productos: Paso 10: Finalmente, Si la ecuación no se encuentra balanceada, es preciso realizar esta operación, mediante el uso de los coeficientes estequiométricos. En este caso se debe agregar un 2 delante del PbO en productos para que coincida la cantidad de oxígeno y luego un 2 frente al Pb en reactivos para que la cantidad de plomo coincida: Autor: Holzmaisters Jonathan. Para repasar lo que leíste, te proponemos que observes y tomes nota del siguiente video tutorial. Autor: Holzmaisters Jonathan. Los óxidos básicos tienen un papel muy importante en la fabricación de muchos de los productos que utilizamos en el día a día. Por ejemplo: Óxido de Magnesio: Se utiliza para la preparación de medicamentos destinados al estómago, y en la fabricación de antídotos para intoxicaciones. Óxido de Zinc: Se utiliza para la fabricación de pinturas, colorantes y pigmentos de teñido. Óxido de Aluminio: Se utiliza para aleaciones de enorme dureza y otros metales de uso industrial. Óxido de Plomo: Se utiliza en la fabricación de vidrio. Te proponemos que realices una actividad sobre la formulación de los óxidos básicos. Para acceder haz CLIC AQUÍ. ______________________________________________________________________________________________________________________________ No metal + O2 --> Anhídrido Ejemplo: 2N2 + 5O2 --> 2N2O5 Fórmula Química: Queda determinada por el no metal y el oxígeno, cuyas valencias o números de oxidación se intercambian y se anotan como subíndices. En el caso de que sean múltiplos, se simplifican. Por ejemplo: S2O6 --> SO3 Nomenclatura: Según la nomenclatura tradicional: ➡️ Si el no metal con el que se combina el oxígeno tiene una sola valencia, se nombra con las palabras Anhídrido de..., y el nombre del metal con el que se combina. ➡️ Si el no metal con el que se combina al oxígeno tiene dos valencias se utilizan los sufijos “oso” e “ico” y se suprime la sílaba “de”: ⏺️ “oso” cuando el elemento usa la menor valencia; Ejemplo: N2O3, valencia del nitrógeno (III): Anhídrido nitroso. ⏺️ “ico” cuando el elemento va con la mayor valencia; Ejemplo: N2O5, valencia del nitrógeno (V): Anhídrido nítrico. ➡️ Si el no metal con el que se combina al oxígeno tiene cuatro valencias se utilizan prefijos “hipo” y “per” y los sufijos “oso” e “ico” y se suprime la sílaba “de”; por ejemplo: cloro, que posee las valencias 1, 3, 5 y 7. ⏺️ Cuando la valencia es 1, se utiliza el prefijo “hipo” y el sufijo “oso”; Anhídrido hipocloroso. ⏺️ Cuando la valencia es 3, se utiliza solamente el sufijo “oso”; Anhídrido cloroso. ⏺️ Cuando la valencia es 5, se utiliza solamente el sufijo “ico”; Anhídrido clórico. ⏺️ Cuando la valencia es 7, se utiliza el prefijo “per” y el sufijo “ico”; Anhídrido perclórico. Ahora te proponemos que leas con atención el siguiente tutorial paso a paso para formular un Óxido ácido o anhídrido. En este tutorial plantearemos la ecuación de formación de un anhídrido, con el objetivo de obtener su fórmula, usando como referencia el nombre que obtiene por nomenclatura tradicional. Vamos paso a paso: Paso 1: En primer lugar, debemos conocer el nombre del compuesto para, a partir de este y teniendo en cuenta las reglas de nomenclatura, poder extraer la información necesaria: Paso 2: Escribimos las fórmulas de los reactivos, en este caso oxígeno (O2) y cloro (Cl2), separados por un signo + (no importa el orden de los reactivos, puede escribirse el O2 o el Cl2 primero y luego el otro): Paso 3: Luego de los reactivos agregamos la flecha de reacción (-->): Paso 4: Empezamos a platear la formula del anhídrido, para ello escribimos el símbolo del no metal (Cl) seguido del símbolo del oxígeno (sin separarlos con +), después de la flecha de reacción: Paso 5: En la tabla periódica buscamos los números de oxidación de cada elemento: Paso 6: Teniendo en cuenta el nombre del compuesto seleccionamos el número de oxidación o valencia correspondiente para cada elemento: El O utilizará el -2 y el Cl el +7 (la mayor de los 4 positivos), ya que el nombre comienza con “per” y termina en “ico”. Paso 7: Escribimos en lápiz los valores seleccionados anteriormente en números romanos sobre cada elemento (este paso es opcional): Paso 8: Escribimos el número de oxidación del oxígeno como subíndice del cloro y viceversa, luego borramos los números de oxidación que escribimos en lápiz: Importante: siempre que, en un compuesto todos los subíndices sean múltiplos entre sí, es necesario simplificarlos, para obtener la formula correcta del anhídrido. En este caso los subíndices no cumplen con esta condición, por lo que se mantienen igual: Paso 9: Revisamos si la ecuación esta balanceada, para ello debemos verificar que cada elemento aparezca la misma cantidad de veces en reactivos y en productos: Paso 10: Finalmente, si la ecuación no se encuentra balanceada, debemos hacerlo empleando coeficientes estequiométricos. En este caso se debe agregar un 2 delante del Cl2O7 en productos y un 7 delante del O2 en los reactivos para que coincida la cantidad de oxígeno y luego se debe agregar un 2 frente al Cl2 en reactivos para que la cantidad de cloro coincida: Autor: Holzmaisters Jonathan. Para repasar lo que leíste, te proponemos que observes y tomes nota del siguiente video tutorial. Autor: Holzmaisters Jonathan. Óxido carbónico o dióxido de carbono: Es un gas incoloro y poco reactivo. Se halla en la tropósfera (capa atmosférica más cercana a la Tierra). Es un gas de efecto invernadero y el aumento de su concentración en la atmósfera está vinculado al cambio climático global, siendo uno de los casos mejor documentados. Fuente: Raynaud, D., J. Jouzel, J.M. Barnola, J. Chappellaz, R.J. Delmas & C. Lorius, 1993. The ice core record of greenhouse gases. Science, 259:926-934. Consultado en: https://www.mendoza.conicet.gov.ar/portal/enciclopedia/terminos/DioxiCar.htm Dióxido de Azufre: El dióxido de azufre se utiliza para fines muy diversos, por ej., como agente reductor en metalurgia, como frigorígeno en la industria del frío, como desinfectante y blanqueador, para la conservación de sustancias alimenticias, como decolorante y fumigante. El dióxido de azufre es uno de los compuestos más importantes de la industria química. El 98% del SO2 técnico se utiliza para la producción de trióxido de azufre como precursor del ácido sulfúrico. Fuente: http://wgbis.ces.iisc.ernet.in/energy/HC270799/HDL/ENV/envsp/Vol323.htm Óxidos de nitrógeno: Los óxidos de nitrógeno son una mezcla de gases compuestos de nitrógeno y oxígeno. El monóxido de nitrógeno y el dióxido de nitrógeno constituyen dos de los óxidos de nitrógeno más importantes toxicológicamente; ninguno de los dos son inflamables y son incoloros a pardo en apariencia a temperatura ambiente. Los óxidos de nitrógeno son usados en la producción de ácido nítrico, lacas, tinturas y otros productos químicos. Los óxidos de nitrógeno se usan en combustibles para cohetes, en la nitrificación de compuestos químicos orgánicos y en la manufactura de explosivos. Fuente: https://www.atsdr.cdc.gov/es/toxfaqs/es_tfacts175.html Te proponemos que realices una actividad sobre la formulación de los óxidos ácidos. Para acceder haz CLIC AQUÍ.
Tutorial paso a paso 4: Formación de un óxido básico a partir de su nombre
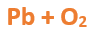



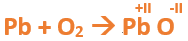
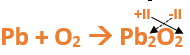
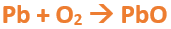



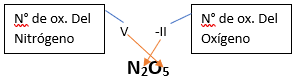
Tutorial paso a paso 5: Formación de un anhídrido a partir de su nombre
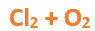

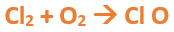

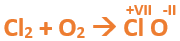
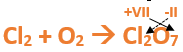
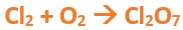



Ahora que terminaste de leer este libro, te invitamos a que realices el CUESTIONARIO DEL TEMA donde encontrarás actividades relacionadas a todo lo abordado en este material. Puedes comenzar haciendo CLIC AQUÍ.
4. Referencias Bibliográficas
Andrade Gamboa, J., & Corso, H. (2012). La química está entre nosotros, de qué están hechas las cosas (átomo a átomo y molécula a molécula) (1° ed.). Buenos Aires: Siglo Veintiuno Editores.
Brown, T. L., LeMay, H. E., Bursten, B. E., & Burdge, J. R. (2004). Química. La ciencia central (9° ed.). México: Pearson Educación.
Cabanne, Daniela; Fernández, Andrea. (2014). "Capítulo III: Formulación de compuestos inorgánicos. Nomenclatura". Cuadernillo de Nivelación en Química. Facultad de Ciencias Forestales. UNaM.
EcuRed. (s.f.). Recuperado el 13 de julio de 2021, de https://www.ecured.cu/Hidr%C3%A1cidos#Usos_de_los_hidr.C3.A1cidos
Garrido, J., & Bianchi, B. (s.f.). El Gato y La Caja. Recuperado el 13 de julio de 2021, de El universo en una tabla: https://elgatoylacaja.com/tabla/oxigeno
Golombek, D., & Schwarzbaum, P. (2012). El nuevo cocinero científico. Cuando la ciencia se mete en la cocina (4ta ed.). Buenos Aires: Siglo Veintiuno Editores.
Peterson, W. R. (2013). Nomenclatura de las sustancias químicas (3° ed.). Barcelona: Editorial Reveté S.A.
Raffino, M. E. (10 de Octubre de 2010). Concepto.de. Recuperado el 8 de Julio de 2021, de https://concepto.de/compuesto-inorganico/#ixzz6KZpCtEgy
Ramírez Vicente, L. (2010). Centro de Innovación y Desarrollo de la Educación a Distancia. Recuperado el 12 de Julio de 2021, de Física y Química: http://recursostic.educacion.es/secundaria/edad/3esofisicaquimica/impresos/quincena8.pdf
Textos.Cientificos.com. (03 de Febrero de 2006). Recuperado el 13 de julio de 2021, de https://www.textoscientificos.com/quimica/hidrogeno