EL ÁTOMO Y SU ESTRUCTURA
.
2. ÁTOMO
2.3. Iones
Como se estableció anteriormente, un átomo es neutro si tiene el mismo número de protones (cargas positivas) que de electrones (cargas negativas). Es decir:
(cargas positivas) + (cargas negativas)= cero
Sin embargo, cuando los átomos se combinan con otros pueden ganar o perder uno o más electrones y convertirse de esta manera en átomos con carga eléctrica. A los átomos con carga, ya sea positiva o negativa, se los denomina IONES.
Un ion es un átomo o grupo de átomos con carga eléctrica.
Para que se forme un ion es necesario que se transfieran los electrones; es decir, un átomo debe perder electrones y otro los debe ganar. Si un átomo neutro gana electrones quedará con exceso de carga negativa, transformándose en un ion negativo que recibe el nombre de ANIÓN.
Veamos como sucede con un ejemplo:
![]()
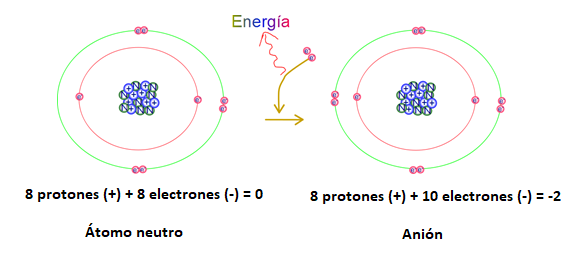 En la figura 2 se representa la ganancia de dos electrones por parte del átomo de oxígeno, el proceso libera energía. El resultado es un ion con carga negativa. La carga neta del ion resulta de la diferencia entre cargas positivas y negativas.
En la figura 2 se representa la ganancia de dos electrones por parte del átomo de oxígeno, el proceso libera energía. El resultado es un ion con carga negativa. La carga neta del ion resulta de la diferencia entre cargas positivas y negativas.
En este caso la carga neta es -2 y el ion formado se representa de la siguiente manera:

![]()
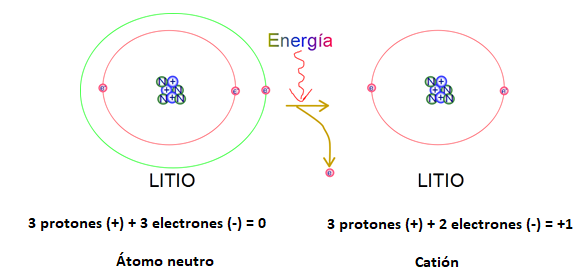
Cuando un átomo pierde electrones, queda con exceso de carga positiva y se llama ion positivo o CATIÓN. Si el litio (Li), que tiene tres protones y tres electrones, pierde un electrón, tendrá un exceso de una carga positiva. (Fig. 3)
El catión formado se representa con el símbolo del elemento y la carga del ion como superíndice, a la derecha del símbolo: Li+
Por lo tanto, siempre que se forma un ion cambia la cantidad de electrones del átomo. Es importante que recuerdes que NUNCA va a cambiar la cantidad de protones del núcleo del átomo; dado que en los cambios químicos ordinarios el núcleo atómico no se ve afectado.
Veamos un ejercicio sencillo para aplicar estos conceptos: Determina el número de electrones para los siguientes iones: Cl1- ; Fe2+ Solución: En primer lugar debemos determinar si los iones son aniones o cationes. De acuerdo a las definiciones dadas, los cationes son átomos con carga positiva y los aniones son átomos con carga negativa. Por lo tanto: El Cl1- es un ANIÓN El Fe2+ es un CATIÓN En segundo lugar, debemos determinar la cantidad de electrones para el átomo neutro. Sabiendo que la cantidad de electrones es igual a la de protones cuando el átomo es neutro, y que Z (número atómico) de cada elemento indica la cantidad de protones, extraemos de la tabla periódica el Número Atómico y determinamos la cantidad de protones y de electrones. El número atómico del cloro (Cl) es 17; por lo tanto posee 17 protones y 17 electrones El número atómico del hierro (Fe) es 26; por lo tanto posee 26 protones y 26 electrones A continuación determinamos la cantidad de electrones para los iones dados de la siguiente manera: Para el Cl1- : la carga negativa -1 indica que el Cloro ganó 1 electrón para formar el anión correspondiente. Por lo tanto si el elemento neutro tenía 17 electrones, el anión tendrá 18 electrones al ganar 1 electrón. Para calcular se puede aplicar el siguiente procedimiento: De la siguiente ecuación despejamos la cantidad de electrones: [cantidad de protones] + [cantidad de electrones] = carga del ion Entonces: [cantidad de electrones]= [cantidad de protones]-[carga del ion] Reemplazamos en la ecuación anterior con los datos correspondientes: cantidad de electrones= 17 - (-1) cantidad de electrones= 18 Para el Fe2+ : la carga positiva 2+ indica que el hierro perdió dos electrones para formar el catión correspondiente. Por lo tanto si el elemento neutro tenía 26 electrones, el catión tendrá 24 electrones al perder 2 electrones. [cantidad de electrones]= [cantidad de protones]-[carga del ion] cantidad de electrones= 26 - (+2) cantidad de electrones= 24 Respuesta: El anión Cl1- tiene 18 electores y el catión Fe2+ tiene 24 electrones.


Vamos a poner en práctica los conceptos desarrollados con una breve actividad. Haz CLIC AQUÍ para comenzar.
