EL ÁTOMO Y SU ESTRUCTURA
| Sitio: | Educación a Distancia - UNaM |
| Curso: | Química |
| Libro: | EL ÁTOMO Y SU ESTRUCTURA |
| Imprimido por: | Cuenta visitante |
| Día: | jueves, 18 de septiembre de 2025, 07:12 |
Descripción
.
1. INTRODUCCIÓN
En este libro vas a encontrar...

Anteriormente, vimos que la química es la ciencia que se ocupa del estudio de la materia y sus propiedades. Pudiste conocer que todo lo que te rodea está formado por materia y que ésta exhibe, cuando se transforma, diferentes propiedades físicas y químicas. Es decir, que cuando te preparas una rodaja de pan tostado, en realidad también estás haciendo química. Los cambios que observas tienen que ver con reacciones químicas que están ocurriendo en el mundo submicroscópico, en el nivel de los átomos y las moléculas; que no podemos ver a simple vista, pero sí podemos percibir y observar sus efectos en el mundo macroscópico.
Es por ello, que para comprender los cambios de la materia que observamos a diario, es necesario que nos adentremos en este mundo submicroscópico y estudiemos "de qué están hechas las cosas".
En este libro examinaremos la estructura básica de un átomo y desarrollaremos conceptos que te ayudarán a entender porqué los átomos de un elemento son diferentes a los de otro. Es así, que presentaremos los conceptos de número atómico y número de masa e isótopo. Luego, veremos brevemente cómo se forman los iones y a qué nos referimos cuando hablamos de isótopos.
Al finalizar, te proponemos una serie de actividades que te ayudarán a fijar los conceptos desarrollados.
2. ÁTOMO
UN POCO DE HISTORIA...
Para iniciar este Capítulo, te proponemos que realices la lectura del siguiente fragmento del texto llamado “¿De qué están hechas las cosas?”1, una pregunta que seguramente te habrás realizado muchas veces a lo largo de tu vida.
¿De qué están hechas las cosas?
Esta interesante pregunta fue motivo de reflexión desde la antigüedad. Ya los filósofos de la Grecia antigua habían dedicado parte de sus pensamientos a darle respuesta. Se le atribuye a Demócrito (ca. 460 a. C.– ca. 370 a. C) la propuesta de que la materia (es decir, todo aquello tangible) está compuesta por pequeñas partículas inobservables a las que llamó “átomos”, palabra que, en griego, significa “indivisible”. De esa manera, se quería dar a entender que el átomo es la mínima porción de materia.
Los antiguos filósofos griegos también clasificaron la materia en diferentes elementos: fuego, tierra, agua y aire. Para no ser menos, Aristóteles (384 a. C.– 322 a. C.) agregó el éter como quinto elemento.
Todas estas concepciones filosóficas eran interpretaciones de la naturaleza que no hacía falta someter a comprobación como exige la ciencia actual. No obstante, la esencia conceptual ha perdurado hasta nuestros días. Unos dos mil doscientos años después de Demócrito, el científico inglés John Dalton (1766–1844) retomó la teoría atomista, pero en un contexto científico experimental moderno, para explicar ciertas observaciones del comportamiento de la materia. Y la noción de elemento fue adoptada para describir todo tipo de materia que no se descompone en otros tipos. De manera que el comportamiento macroscópico (lo observable) de esas formas simples de materia se pudieron asociar a la naturaleza microscópica (lo inobservables) de lo indivisible: el átomo.
En efecto, los átomos existen y conforman la materia que nos rodea, incluidos nosotros mismos. Y sus diferentes clases dan origen a los distintos elementos químicos. […]
En pocas palabras… La materia está constituida por partículas. Estas partículas pueden ser: átomos, iones o moléculas. Es necesario que puedas reconocer y diferenciar los diferentes tipos de partículas. Así podrás comprender mejor y explicar las diferencias entre las sustancias y sus propiedades específicas.
El concepto de átomo es relativamente reciente. Como se expresa en el texto anterior, los filósofos griegos fueron los primeros en utilizar el vocablo "átomo", allá por el año 500 AC, para referirse a la idea de que todo debía contener partículas minúsculas. Leucipo y Demócrito argumentaban que, si un material se corta con un cuchillo es porque está formado por partículas muy pequeñas, entre las cuales quedan intersticios vacíos por donde la hoja del cuchillo puede pasar. A esas partículas pequeñas las llamaron átomos, vocablo que proviene del griego y significa "indivisible", "sin partes". Según los atomistas, el universo estaba formado por espacio vacío y un número casi infinito de átomos. Esta teoría era de naturaleza filosófica, es decir, no apoya sus postulados mediante experimentos. Los filósofos griegos utilizaban su lógica para imaginar un modelo que les permitiera explicar el comportamiento de lo que los rodeaba.
La idea de que la materia estaba formada por partículas extremadamente pequeñas e indivisibles se convirtió en teoría científica en 1808 cuando John Dalton desarrolló la teoría atómica, que proponía que todo elemento está conformado por pequeñas partículas llamadas átomos y que éstos se combinan para formar compuestos. Es decir, que los átomos son los bloques de construcción básicos de toda la materia.
A diferencia de los filósofos griegos, Dalton basó su teoría en la experimentación, por ello se considera una teoría científica. Después de analizar un gran número de observaciones, Dalton planteó los postulados de su teoría atómica:
- Toda la materia está formada por partículas más pequeñas e indivisibles llamadas átomos.
- Todos los átomos de un elemento dado son idénticos; los átomos de elementos diferentes son diferentes y tienen propiedades distintas.
- Los átomos de un elemento no se transforman en átomos diferentes durante las reacciones químicas; los átomos no se crean ni se destruyen en las reacciones químicas.
- Los compuestos se forman cuando átomos de diferentes elementos se combinan entre sí en proporciones de números enteros y pequeños. El número y tipo relativo de átomos de un compuesto dado son constantes.
Dalton creía que los átomos eran esferas sólidas indivisibles. Hoy sabemos que esta idea es incorrecta. Sin embargo, a pesar de las limitaciones de su teoría, las ideas de Dalton sentaron las bases de la actual teoría atómica; éstas fueron más tarde modificadas y ampliadas por otros científicos. Para llegar a la teoría actual, hubo otras que construyeron las bases del conocimiento sobre el átomo. Te invitamos a recorrer su historia con este video:
Video recuperado de: https://www.educ.ar/recursos/152913/la-clase-del-d%C3%ADa:-modelo-at%C3%B3mico
Ahora sabemos que los átomos están constituidos por partículas aún más pequeñas denominadas partículas fundamentales o subatómicas. Éstas son, básicamente, tres: electrones, protones y neutrones. Vamos a desarrollar estos conceptos en el capítulo siguiente. 1Andrade Gamboa J y Corso H. 2013. La química está entre nosotros: De qué están hechas las cosas (átomo a átomo y molécula a molécula). 1° Ed. Colección Ciencia que Ladra. Siglo Veintiuno Editores. Buenos Aires. Pp. 17 y 18.
2.1. Partículas fundamentales

Imagina que tomas una delgada lámina de oro y la cortas en mitades muchas veces, una y otra vez. ¿Podríamos dividirla indefinidamente en trozos más y más pequeños? ¿Seguirían siendo oro esos trozos? ¿Crees que después de muchas divisiones llegaríamos a tener una partícula tan pequeña que no se podría dividir más veces? Anota tu respuesta en un cuaderno para retomarla al finalizar este capítulo.
La teoría atómica moderna se desarrolló como resultado de numerosas observaciones experimentales realizadas por muchos científicos a mediados del siglo XIX. Estos estudios se basaron, por un lado, en la naturaleza eléctrica de la materia, y por otro, en la interacción de la materia con la energía en forma de luz.

En caso de que quieras saber más acerca de los experimentos realizados, puedes acceder a más información haciendo CLIC AQUÍ.
Los resultados de estas investigaciones permitieron a los científicos darse cuenta de que los átomos se componen de partículas más fundamentales y les ayudó a describir cómo estaban distribuidas estas partículas en los mismos. Consecuentemente, pudieron concluir que las propiedades físicas y químicas de cada elemento dependían de la disposición de los electrones en los átomos.
A lo largo de la historia se desarrollaron distintos modelos para representar la estructura atómica; éstos fueron cambiando y evolucionando a lo largo del tiempo hasta llegar al modelo atómico actual. En esta infografía te mostramos brevemente cómo fue evolucionando éste a medida que los científicos realizaban nuevos descubrimientos.

El modelo atómico de Bohr introduce dos ideas fundamentales que están incorporadas en el modelo vigente: establece que los electrones solo existen en ciertos niveles discretos de energía y que en el movimiento de un electrón de un nivel a otro interviene energía. Es decir, que la energía está "cuantizada", solo puede tomar ciertos valores definidos. Sin embargo, experimentos más detallados mostraron que el modelo de Bohr no explica correctamente las observaciones experimentales. Recién en 1930 se sentaron las bases del modelo atómico actual, el modelo mecano cuántico. El estudio del modelo mecano cuántico escapa a los alcances de este curso, lo estudiarás más adelante.
Estructura del átomo
Recordando lo que vimos anteriormente, la teoría atómica de Dalton planteaba que el átomo era una partícula indivisible e indestructible. Ahora sabemos que todos los átomos se componen de piezas aún más pequeñas llamadas partículas subatómicas; los electrones, protones y neutrones.
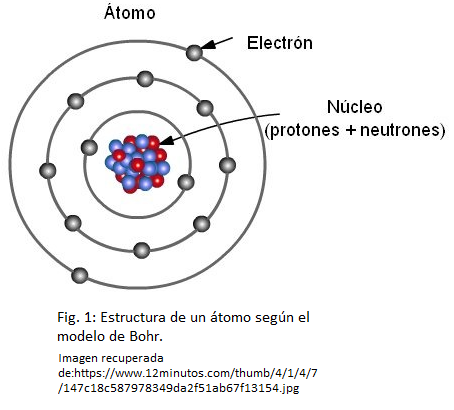 Los protones y neutrones forman un cuerpo central, muy pequeño, denominado núcleo atómico, y los electrones se distribuyen en el espacio como si fueran una nube de electrones alrededor del mismo. En la Fig. 1 te mostramos una ilustración del átomo utilizando el modelo atómico de Bohr. Por su sencillez, este modelo continúa siendo muy utilizado para representar la estructura de un átomo.
Los protones y neutrones forman un cuerpo central, muy pequeño, denominado núcleo atómico, y los electrones se distribuyen en el espacio como si fueran una nube de electrones alrededor del mismo. En la Fig. 1 te mostramos una ilustración del átomo utilizando el modelo atómico de Bohr. Por su sencillez, este modelo continúa siendo muy utilizado para representar la estructura de un átomo.
 La carga eléctrica de un protón es positiva (+1,602 x 10-19 C), y la de un electrón es negativa (-1,602 x 10-19 C). Es decir, la carga eléctrica de ambas partículas es de igual magnitud pero de signo opuesto. Por comodidad, las cargas de las partículas subatómicas suelen expresarse como múltiplos de esta carga. Entonces, la carga del electrón es 1-, y la del protón, 1+. Los neutrones no tienen carga eléctrica, son neutros.
La carga eléctrica de un protón es positiva (+1,602 x 10-19 C), y la de un electrón es negativa (-1,602 x 10-19 C). Es decir, la carga eléctrica de ambas partículas es de igual magnitud pero de signo opuesto. Por comodidad, las cargas de las partículas subatómicas suelen expresarse como múltiplos de esta carga. Entonces, la carga del electrón es 1-, y la del protón, 1+. Los neutrones no tienen carga eléctrica, son neutros. En la tabla a continuación, se presenta de manera resumida la masa y carga de las tres partículas fundamentales de la materia:
|
Partícula |
Masa |
Carga (escala relativa) |
|
Electrón (e- ) |
9,1095 x 10-28 |
1 - |
|
Protón (p o p+ ) |
1,67252 x 10-24 |
1+ |
|
Neutrón (n o n0 ) |
1,67495 x 10-24 |
Sin carga |
Los átomos tienen números iguales de protones y de electrones, así que no tienen carga eléctrica neta. Los átomos son eléctricamente neutros.
Los electrones son atraídos hacia los protones del núcleo por la fuerza que existe entre partículas con cargas eléctricas opuestas. La masa de un electrón es muy pequeña en comparación con la de un protón o un neutrón. Necesitaríamos 1836 electrones para igualar la masa de un protón. Dado que los neutrones y protones se encuentran en el núcleo, el núcleo atómico concentra casi la totalidad de la masa atómica.
Los átomos son extremadamente pequeños; tienen diámetros de entre 1 x 10-10 metros (m) y 5 x 10-10 m. La unidad que se utiliza habitualmente para expresar el tamaño de los átomos es el angstrom (Å). Un angstrom es igual a 10-10 m, es decir que es una unidad de medida equivalente a la diezmilmillonésima parte del metro: 0,000 000 000 1 metros. Seguramente te debe resultar muy difícil imaginarte estas dimensiones y hacerte una idea del tamaño de un átomo. Por suerte existen muchas analogías que te van a ayudar a entender lo diminuto que son los átomos; como que en el grosor de un cabello humano hay 500.000 átomos de carbono alineados, uno al lado del otro; o que en la cabeza de un alfiler hay 5 billones de ellos. La más ilustrativa es la de que si un átomo fuera del tamaño de un estadio de fútbol, los electrones se situarían en la parte alta de las gradas y se verían como pequeñas cabezas de alfiler, y el núcleo estaría en el centro del campo de fútbol y su tamaño correspondería al de un guisante. ¡INCREÍBLE! ¿no? Si aún te cuesta hacerte la idea de que tan diminuto es un átomo, aquí te dejamos este video:
Video recuperado de: https://youtu.be/yQP4UJhNn0I
Ahora bien, si todos los átomos están formados por las mismas tres partículas subatómicas, ¿qué hace a un átomo diferente de otro? Vamos a responder esta pregunta en el capítulo siguiente.
 Pero antes de avanzar, volvamos al interrogante planteado al inicio de esta página: ¿podríamos dividir una lámina de oro indefinidamente en trozos cada vez más pequeños, hasta obtener una partícula tan diminuta que no se podría dividir más veces? Esta partícula, ¿seguiría siendo oro?
Pero antes de avanzar, volvamos al interrogante planteado al inicio de esta página: ¿podríamos dividir una lámina de oro indefinidamente en trozos cada vez más pequeños, hasta obtener una partícula tan diminuta que no se podría dividir más veces? Esta partícula, ¿seguiría siendo oro?
¿Cuál es tu respuesta ahora que has finalizado este capítulo?
Al dividir una muestra de oro en trozos cada vez más pequeños, finalmente se encuentra una unidad básica que no puede ser dividida sin cambiar la naturaleza o identidad del elemento. Esta unidad básica es el Átomo. Un átomo es la partícula más pequeña que puede existir de un elemento, conservando las propiedades de dicho elemento.
2.2. Número atómico y Número másico

Los distintos tipos de átomos que se encuentran en la naturaleza se diferencian entre sí, básicamente, en la cantidad de protones que contienen sus núcleos. Todos los átomos de un elemento tienen el mismo número de protones en el núcleo, eso hace que el átomo de un elemento sea diferente al átomo de otro elemento. Por ejemplo: todos los átomos del elemento Oxígeno (O) tienen 8 protones en su núcleo, en cambio los átomos del elemento Nitrógeno (N) tienen 7 protones. El número de protones que posee un átomo se denomina Número Atómico y se representa con la letra Z. Precisamente es el número por el cual se hallan ordenados los elementos en la Tabla Periódica.
Como el átomo es eléctricamente neutro (sin carga eléctrica), el número de protones es igual al número de electrones, razón por la cual Z también será igual al número de electrones. Siguiendo con el ejemplo anterior, todos los átomos del oxígeno tienen 8 protones y 8 electrones, mientras que los átomos del nitrógeno tienen 7 protones y 7 electrones.
Por otro lado, el número de protones y el número de neutrones determinan la masa del núcleo, por lo tanto el número de masa o Número Másico (A) es la suma del número de protones y el número de neutrones.

Entonces, si deseas conocer el número de neutrones presentes en el átomo, sólo debes despejar la ecuación anterior y restar al Número másico el Número atómico o de protones:

Tanto el Número Atómico como el Número Másico se utilizan para identificar y caracterizar a un determinado tipo de átomo.
Por ejemplo:
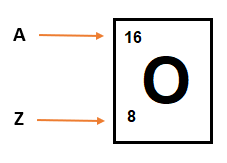 El número atómico (Z) nos indica que se trata de un átomo de Oxígeno, al cual se lo representa simbólicamente con la letra O.
El número atómico (Z) nos indica que se trata de un átomo de Oxígeno, al cual se lo representa simbólicamente con la letra O.
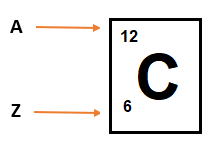 Z nos indica que se trata de un átomo de Carbono; posee en su núcleo dos protones menos que el átomo de oxígeno.
Z nos indica que se trata de un átomo de Carbono; posee en su núcleo dos protones menos que el átomo de oxígeno.
 Veamos un ejercicio sencillo para aplicar estos conceptos:
Veamos un ejercicio sencillo para aplicar estos conceptos:
Consigna: Determina el número de protones, neutrones y electrones del boro.
Solución: De la Tabla Periódica se extrae el número atómico (Z) del boro que es 5, de modo que posee 5 protones. El número másico (A) es 11, por lo que el número de neutrones se calcula reemplazando en:
n = A-Z de modo que; n = 11-5 = 6
Como el átomo es neutro, es decir sin carga eléctrica, el número de electrones es igual al de protones, o sea 5.
Respuesta: El boro tiene 5 protones, 5 electrones y 6 neutrones.

Ahora te proponemos una breve actividad para que pongas en práctica los conceptos desarrollados. ¡Adelante, vamos a practicar! Para acceder a la actividad haz CLIC AQUÍ.
2.3. Iones
Como se estableció anteriormente, un átomo es neutro si tiene el mismo número de protones (cargas positivas) que de electrones (cargas negativas). Es decir:
(cargas positivas) + (cargas negativas)= cero
Sin embargo, cuando los átomos se combinan con otros pueden ganar o perder uno o más electrones y convertirse de esta manera en átomos con carga eléctrica. A los átomos con carga, ya sea positiva o negativa, se los denomina IONES.
Un ion es un átomo o grupo de átomos con carga eléctrica.
Para que se forme un ion es necesario que se transfieran los electrones; es decir, un átomo debe perder electrones y otro los debe ganar. Si un átomo neutro gana electrones quedará con exceso de carga negativa, transformándose en un ion negativo que recibe el nombre de ANIÓN.
Veamos como sucede con un ejemplo:
![]()
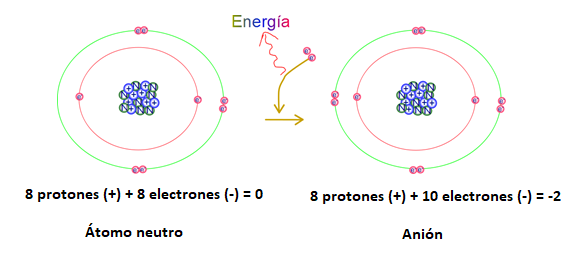 En la figura 2 se representa la ganancia de dos electrones por parte del átomo de oxígeno, el proceso libera energía. El resultado es un ion con carga negativa. La carga neta del ion resulta de la diferencia entre cargas positivas y negativas.
En la figura 2 se representa la ganancia de dos electrones por parte del átomo de oxígeno, el proceso libera energía. El resultado es un ion con carga negativa. La carga neta del ion resulta de la diferencia entre cargas positivas y negativas.
En este caso la carga neta es -2 y el ion formado se representa de la siguiente manera:

![]()
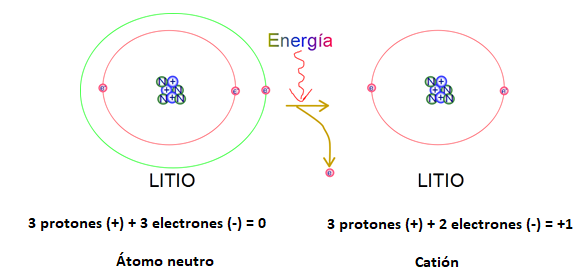
Cuando un átomo pierde electrones, queda con exceso de carga positiva y se llama ion positivo o CATIÓN. Si el litio (Li), que tiene tres protones y tres electrones, pierde un electrón, tendrá un exceso de una carga positiva. (Fig. 3)
El catión formado se representa con el símbolo del elemento y la carga del ion como superíndice, a la derecha del símbolo: Li+
Por lo tanto, siempre que se forma un ion cambia la cantidad de electrones del átomo. Es importante que recuerdes que NUNCA va a cambiar la cantidad de protones del núcleo del átomo; dado que en los cambios químicos ordinarios el núcleo atómico no se ve afectado.
Veamos un ejercicio sencillo para aplicar estos conceptos: Determina el número de electrones para los siguientes iones: Cl1- ; Fe2+ Solución: En primer lugar debemos determinar si los iones son aniones o cationes. De acuerdo a las definiciones dadas, los cationes son átomos con carga positiva y los aniones son átomos con carga negativa. Por lo tanto: El Cl1- es un ANIÓN El Fe2+ es un CATIÓN En segundo lugar, debemos determinar la cantidad de electrones para el átomo neutro. Sabiendo que la cantidad de electrones es igual a la de protones cuando el átomo es neutro, y que Z (número atómico) de cada elemento indica la cantidad de protones, extraemos de la tabla periódica el Número Atómico y determinamos la cantidad de protones y de electrones. El número atómico del cloro (Cl) es 17; por lo tanto posee 17 protones y 17 electrones El número atómico del hierro (Fe) es 26; por lo tanto posee 26 protones y 26 electrones A continuación determinamos la cantidad de electrones para los iones dados de la siguiente manera: Para el Cl1- : la carga negativa -1 indica que el Cloro ganó 1 electrón para formar el anión correspondiente. Por lo tanto si el elemento neutro tenía 17 electrones, el anión tendrá 18 electrones al ganar 1 electrón. Para calcular se puede aplicar el siguiente procedimiento: De la siguiente ecuación despejamos la cantidad de electrones: [cantidad de protones] + [cantidad de electrones] = carga del ion Entonces: [cantidad de electrones]= [cantidad de protones]-[carga del ion] Reemplazamos en la ecuación anterior con los datos correspondientes: cantidad de electrones= 17 - (-1) cantidad de electrones= 18 Para el Fe2+ : la carga positiva 2+ indica que el hierro perdió dos electrones para formar el catión correspondiente. Por lo tanto si el elemento neutro tenía 26 electrones, el catión tendrá 24 electrones al perder 2 electrones. [cantidad de electrones]= [cantidad de protones]-[carga del ion] cantidad de electrones= 26 - (+2) cantidad de electrones= 24 Respuesta: El anión Cl1- tiene 18 electores y el catión Fe2+ tiene 24 electrones.


Vamos a poner en práctica los conceptos desarrollados con una breve actividad. Haz CLIC AQUÍ para comenzar.
2.4. Isótopos
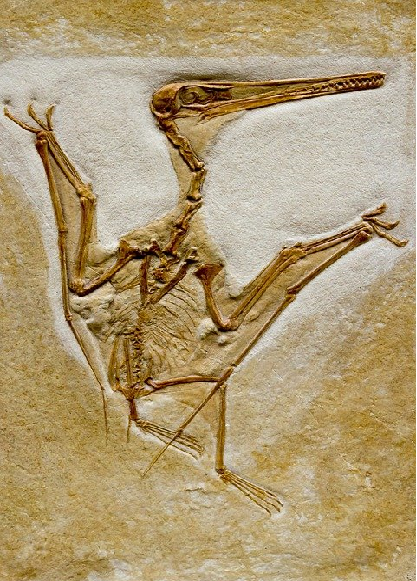
Es muy posible que más de una vez hayas oído hablar que los paleontólogos emplean el Carbono-14 para determinar la edad de los fósiles. Para calcular cuántos años tiene un fósil, los científicos utilizan métodos isotópicos; llamados así porque utilizan isótopos de diferentes elementos.

Si tienes curiosidad y quieres saber cómo se calcula la edad de los fósiles, aquí te dejamos esta nota. CLIC AQUÍ
Casi todos los elementos de la tabla periódica, como el Carbono, el Oxígeno o el Hidrógeno, no son idénticos entre sí. Los átomos de un mismo elemento pueden diferir en el número de neutrones que contienen. A estos átomos, que tienen el mismo número atómico (Z) pero distintos números másicos (A), se los denomina isótopos.

Por ejemplo el carbono 14 (14C) tiene dos neutrones más que el carbono 12 (12C), que es el más abundante en la naturaleza. Ambos tienen 6 protones en su núcleo pero la diferencia en el número de protones hace que sus masas sean diferentes. Un átomo de un isótopo específico es un núclido. Es así que, un átomo de 14C es un núclido de 14C. Como señalamos anteriormente, casi todos los elementos poseen isótopos. Por ejemplo, existen tres clases de átomos de hidrógeno, que se conocen con los nombres de hidrógeno (protio), deuterio y tritio (es el único elemento para el cual cada isótopo tiene nombre distinto). El número atómico (Z) de los tres isótopos es 1 pero: 1H posee 1 protón y ningún neutrón, mientras que el 2H tiene 1 protón y 1 neutrón y el 3H posee 1 protón y 2 neutrones.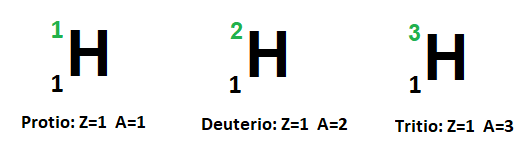
En la naturaleza, la masa de un elemento contiene una mezcla de isótopos, por esta razón, la masa atómica relativa de un elemento es igual al promedio de las masas atómicas relativas de los diferentes isótopos, considerando su abundancia natural. Por ejemplo, para el elemento carbono, el isótopo más abundante es el 12C, pero como también existen pequeñas cantidades de 13C y 14C, la masa atómica relativa de carbono es 12.011. Ésta es la masa que aparece debajo del símbolo en la tabla periódica.
ACTIVIDADES PRÁCTICAS
Ahora que terminaste de leer este libro, te invitamos a que completes el CUESTIONARIO DEL TEMA, dónde encontrarás actividades relacionadas a todo lo abordado en este material. Accede al cuestionario haciendo CLIC AQUÍ.
3. REFERENCIAS
.
.
Aldabe, S., Aramendía, P. y Lacreu, L. (1.999) "Química 1, fundamentos". Ediciones Colihue.
ANBariloche.com.ar. (07 de Marzo de 2016). Recuperado el 19 de Julio de 2021, de https://www.anbariloche.com.ar/noticias/2016/03/07/52098-millones-de-anos-en-la-tierra-como-sabemos-la-edad-de-los-fosiles
Andrade Gamboa, J., & Corso, H. (2012). La química está entre nosotros, de qué están hechas las cosas (átomo a átomo y molécula a molécula) (1° ed.). Buenos Aires: Siglo Veintiuno Editores.
Brown, T. L., LeMay, H. E., Bursten, B. E., & Burdge, J. R. (2004). Química. La ciencia central (9° ed.). México: Pearson Educación.
Cabanne, D. y Fernández, A. (2014). "Capítulo I: Estructura y propiedades de la materia". Cuadernillo de Nivelación en Química. Facultad de Ciencias Forestales. UNaM.
Candás, A., Fernández, D., Gordillo, G. y Wolf, E. (2005). "Química. Estructura, propiedades y transformaciones de la materia". Ed. Estrada.
Chang, R., College, W. (2002). "Química, séptima edición". McGraw-Hill Interamericana Editores S.A.
Educ.arportal. Modelo atómico. Los atomistas griegos [Archivo de Video]. Recuperado de https://www.educ.ar/recursos/152913/la-clase-del-d%C3%ADa:-modelo-at%C3%B3mico
Gellon, G. (2012). Había una vez un átomo o cómo los científicos imaginan lo invisible (1° edición). Buenos Aires: Siglo Veintiuno Editores.
Parra, S. (12 de Julio de 2012). Algunas cifras y analogías sobre los átomos. Recuperado el 19 de Julio de 2021, https://www.xatakaciencia.com/fisica/algunas-cifras-y-analogias-sobre-los-atomos#:~:text=Otra%20analog%C3%ADa%20para%20entender%20lo,la%20palma%20de%20nuestra%20mano.
TED-Ed. (16 de Abril de 2012). Jonathan Bergmann ¿Cómo de pequeño es un átomo? [Archivo de Video]. https://www.youtube.com/watch?v=yQP4UJhNn0I
Whitten, K., Davis, R., Peck, M. y Stanley, G. (2008). "Química, octava edición". Ed. CENGAGE Learning.
