EL ÁTOMO Y SU ESTRUCTURA
.
2. ÁTOMO
2.4. Isótopos
Es muy posible que más de una vez hayas oído hablar que los paleontólogos emplean el Carbono-14 para determinar la edad de los fósiles. Para calcular cuántos años tiene un fósil, los científicos utilizan métodos isotópicos; llamados así porque utilizan isótopos de diferentes elementos.

Si tienes curiosidad y quieres saber cómo se calcula la edad de los fósiles, aquí te dejamos esta nota. CLIC AQUÍ
Casi todos los elementos de la tabla periódica, como el Carbono, el Oxígeno o el Hidrógeno, no son idénticos entre sí. Los átomos de un mismo elemento pueden diferir en el número de neutrones que contienen. A estos átomos, que tienen el mismo número atómico (Z) pero distintos números másicos (A), se los denomina isótopos.

Por ejemplo el carbono 14 (14C) tiene dos neutrones más que el carbono 12 (12C), que es el más abundante en la naturaleza. Ambos tienen 6 protones en su núcleo pero la diferencia en el número de protones hace que sus masas sean diferentes. Un átomo de un isótopo específico es un núclido. Es así que, un átomo de 14C es un núclido de 14C. Como señalamos anteriormente, casi todos los elementos poseen isótopos. Por ejemplo, existen tres clases de átomos de hidrógeno, que se conocen con los nombres de hidrógeno (protio), deuterio y tritio (es el único elemento para el cual cada isótopo tiene nombre distinto). El número atómico (Z) de los tres isótopos es 1 pero: 1H posee 1 protón y ningún neutrón, mientras que el 2H tiene 1 protón y 1 neutrón y el 3H posee 1 protón y 2 neutrones.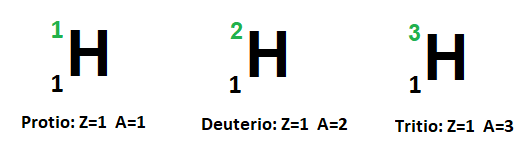
En la naturaleza, la masa de un elemento contiene una mezcla de isótopos, por esta razón, la masa atómica relativa de un elemento es igual al promedio de las masas atómicas relativas de los diferentes isótopos, considerando su abundancia natural. Por ejemplo, para el elemento carbono, el isótopo más abundante es el 12C, pero como también existen pequeñas cantidades de 13C y 14C, la masa atómica relativa de carbono es 12.011. Ésta es la masa que aparece debajo del símbolo en la tabla periódica.
ACTIVIDADES PRÁCTICAS
Ahora que terminaste de leer este libro, te invitamos a que completes el CUESTIONARIO DEL TEMA, dónde encontrarás actividades relacionadas a todo lo abordado en este material. Accede al cuestionario haciendo CLIC AQUÍ.
