EL ÁTOMO Y SU ESTRUCTURA
.
2. ÁTOMO
2.1. Partículas fundamentales

Imagina que tomas una delgada lámina de oro y la cortas en mitades muchas veces, una y otra vez. ¿Podríamos dividirla indefinidamente en trozos más y más pequeños? ¿Seguirían siendo oro esos trozos? ¿Crees que después de muchas divisiones llegaríamos a tener una partícula tan pequeña que no se podría dividir más veces? Anota tu respuesta en un cuaderno para retomarla al finalizar este capítulo.
La teoría atómica moderna se desarrolló como resultado de numerosas observaciones experimentales realizadas por muchos científicos a mediados del siglo XIX. Estos estudios se basaron, por un lado, en la naturaleza eléctrica de la materia, y por otro, en la interacción de la materia con la energía en forma de luz.

En caso de que quieras saber más acerca de los experimentos realizados, puedes acceder a más información haciendo CLIC AQUÍ.
Los resultados de estas investigaciones permitieron a los científicos darse cuenta de que los átomos se componen de partículas más fundamentales y les ayudó a describir cómo estaban distribuidas estas partículas en los mismos. Consecuentemente, pudieron concluir que las propiedades físicas y químicas de cada elemento dependían de la disposición de los electrones en los átomos.
A lo largo de la historia se desarrollaron distintos modelos para representar la estructura atómica; éstos fueron cambiando y evolucionando a lo largo del tiempo hasta llegar al modelo atómico actual. En esta infografía te mostramos brevemente cómo fue evolucionando éste a medida que los científicos realizaban nuevos descubrimientos.

El modelo atómico de Bohr introduce dos ideas fundamentales que están incorporadas en el modelo vigente: establece que los electrones solo existen en ciertos niveles discretos de energía y que en el movimiento de un electrón de un nivel a otro interviene energía. Es decir, que la energía está "cuantizada", solo puede tomar ciertos valores definidos. Sin embargo, experimentos más detallados mostraron que el modelo de Bohr no explica correctamente las observaciones experimentales. Recién en 1930 se sentaron las bases del modelo atómico actual, el modelo mecano cuántico. El estudio del modelo mecano cuántico escapa a los alcances de este curso, lo estudiarás más adelante.
Estructura del átomo
Recordando lo que vimos anteriormente, la teoría atómica de Dalton planteaba que el átomo era una partícula indivisible e indestructible. Ahora sabemos que todos los átomos se componen de piezas aún más pequeñas llamadas partículas subatómicas; los electrones, protones y neutrones.
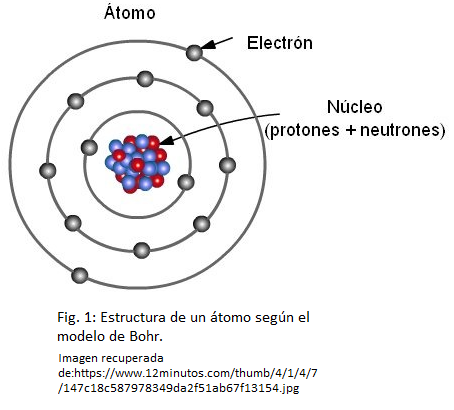 Los protones y neutrones forman un cuerpo central, muy pequeño, denominado núcleo atómico, y los electrones se distribuyen en el espacio como si fueran una nube de electrones alrededor del mismo. En la Fig. 1 te mostramos una ilustración del átomo utilizando el modelo atómico de Bohr. Por su sencillez, este modelo continúa siendo muy utilizado para representar la estructura de un átomo.
Los protones y neutrones forman un cuerpo central, muy pequeño, denominado núcleo atómico, y los electrones se distribuyen en el espacio como si fueran una nube de electrones alrededor del mismo. En la Fig. 1 te mostramos una ilustración del átomo utilizando el modelo atómico de Bohr. Por su sencillez, este modelo continúa siendo muy utilizado para representar la estructura de un átomo.
 La carga eléctrica de un protón es positiva (+1,602 x 10-19 C), y la de un electrón es negativa (-1,602 x 10-19 C). Es decir, la carga eléctrica de ambas partículas es de igual magnitud pero de signo opuesto. Por comodidad, las cargas de las partículas subatómicas suelen expresarse como múltiplos de esta carga. Entonces, la carga del electrón es 1-, y la del protón, 1+. Los neutrones no tienen carga eléctrica, son neutros.
La carga eléctrica de un protón es positiva (+1,602 x 10-19 C), y la de un electrón es negativa (-1,602 x 10-19 C). Es decir, la carga eléctrica de ambas partículas es de igual magnitud pero de signo opuesto. Por comodidad, las cargas de las partículas subatómicas suelen expresarse como múltiplos de esta carga. Entonces, la carga del electrón es 1-, y la del protón, 1+. Los neutrones no tienen carga eléctrica, son neutros. En la tabla a continuación, se presenta de manera resumida la masa y carga de las tres partículas fundamentales de la materia:
|
Partícula |
Masa |
Carga (escala relativa) |
|
Electrón (e- ) |
9,1095 x 10-28 |
1 - |
|
Protón (p o p+ ) |
1,67252 x 10-24 |
1+ |
|
Neutrón (n o n0 ) |
1,67495 x 10-24 |
Sin carga |
Los átomos tienen números iguales de protones y de electrones, así que no tienen carga eléctrica neta. Los átomos son eléctricamente neutros.
Los electrones son atraídos hacia los protones del núcleo por la fuerza que existe entre partículas con cargas eléctricas opuestas. La masa de un electrón es muy pequeña en comparación con la de un protón o un neutrón. Necesitaríamos 1836 electrones para igualar la masa de un protón. Dado que los neutrones y protones se encuentran en el núcleo, el núcleo atómico concentra casi la totalidad de la masa atómica.
Los átomos son extremadamente pequeños; tienen diámetros de entre 1 x 10-10 metros (m) y 5 x 10-10 m. La unidad que se utiliza habitualmente para expresar el tamaño de los átomos es el angstrom (Å). Un angstrom es igual a 10-10 m, es decir que es una unidad de medida equivalente a la diezmilmillonésima parte del metro: 0,000 000 000 1 metros. Seguramente te debe resultar muy difícil imaginarte estas dimensiones y hacerte una idea del tamaño de un átomo. Por suerte existen muchas analogías que te van a ayudar a entender lo diminuto que son los átomos; como que en el grosor de un cabello humano hay 500.000 átomos de carbono alineados, uno al lado del otro; o que en la cabeza de un alfiler hay 5 billones de ellos. La más ilustrativa es la de que si un átomo fuera del tamaño de un estadio de fútbol, los electrones se situarían en la parte alta de las gradas y se verían como pequeñas cabezas de alfiler, y el núcleo estaría en el centro del campo de fútbol y su tamaño correspondería al de un guisante. ¡INCREÍBLE! ¿no? Si aún te cuesta hacerte la idea de que tan diminuto es un átomo, aquí te dejamos este video:
Video recuperado de: https://youtu.be/yQP4UJhNn0I
Ahora bien, si todos los átomos están formados por las mismas tres partículas subatómicas, ¿qué hace a un átomo diferente de otro? Vamos a responder esta pregunta en el capítulo siguiente.
 Pero antes de avanzar, volvamos al interrogante planteado al inicio de esta página: ¿podríamos dividir una lámina de oro indefinidamente en trozos cada vez más pequeños, hasta obtener una partícula tan diminuta que no se podría dividir más veces? Esta partícula, ¿seguiría siendo oro?
Pero antes de avanzar, volvamos al interrogante planteado al inicio de esta página: ¿podríamos dividir una lámina de oro indefinidamente en trozos cada vez más pequeños, hasta obtener una partícula tan diminuta que no se podría dividir más veces? Esta partícula, ¿seguiría siendo oro?
¿Cuál es tu respuesta ahora que has finalizado este capítulo?
Al dividir una muestra de oro en trozos cada vez más pequeños, finalmente se encuentra una unidad básica que no puede ser dividida sin cambiar la naturaleza o identidad del elemento. Esta unidad básica es el Átomo. Un átomo es la partícula más pequeña que puede existir de un elemento, conservando las propiedades de dicho elemento.


