FORMULACIÓN Y NOMENCLATURA DE COMPUESTOS INORGÁNICOS PARTE I
 . . . Imagen extraída de: Cuaderno de cultura científica "De los compuestos químicos"
. . . Imagen extraída de: Cuaderno de cultura científica "De los compuestos químicos"
3. COMBINACIONES BINARIAS
3.1. Combinaciones Binarias con Hidrógeno
Para comenzar a pensar en las combinaciones binarias con el hidrógeno, te proponemos que leas el siguiente fragmento del texto “El Hidrógeno” del sitio web: TextosCientificos.com.
El hidrógeno al combinarse con otros elementos, forma sustancias con propiedades muy diferentes. Algunos de estos compuestos son:
-
- Los hidruros: compuestos formados por cualquier elemento e Hidrógeno, pueden ser:
- Hidruros Metálicos: se forman por la combinación del hidrógeno con elementos mucho menos electronegativos que él. Un caso especial son los hidruros que se forman con los metales de transición (Peterson, 2013).
Son compuestos binarios constituidos por un elemento metálico y el hidrógeno. En estos hidruros, el hidrógeno siempre trabaja con n° de oxidación -1.
Se obtienen de acuerdo con la siguiente ecuación general:
Metal + H2 --> Hidruro metálico
Ejemplo: Ca + H2 --> CaH2
Fórmula Química: Queda determinada por el metal y el hidrógeno, cuyas valencias o números de oxidación se intercambian y se anotan como subíndices; se escribe a la izquierda el metal (por ser el más electropositivo) y el hidrógeno, a la derecha (por ser el menos electropositivo).
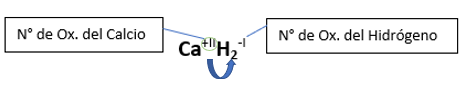
En la fórmula de un compuesto la suma de los números de oxidación entre los elementos debe ser cero. Lo que significa que la molécula será neutra y sin carga, a menos que la fórmula indique lo contrario, con una carga positiva o negativa como en el caso de los iones.
Nomenclatura:
Según la nomenclatura tradicional:
➡️ Si el metal con el que se combina el hidrógeno tiene una sola valencia, se nombra con las palabras Hidruro de..., y el nombre del metal con el que se combina. Ejemplo: CaH2; Hidruro de Calcio.
➡️ Si el metal con el que se combina al hidrógeno tiene dos valencias se utilizan los sufijos “oso” e “ico” y se suprime la sílaba “de”:
⏺️“oso” cuando el elemento usa la menor valencia; Ejemplo: FeH2, valencia del hierro (II): Hidruro ferroso.
⏺️“ico” cuando el elemento va con la mayor valencia; Ejemplo: FeH3, valencia del hierro (III): Hidruro férrico.
Ahora te proponemos que leas con atención el siguiente tutorial paso a paso para formular un Hidruro Metálico.
Tutorial paso a paso 1: Formación de un hidruro metálico a partir de su nombre
En este tutorial plantearemos la ecuación de formación de un hidruro metálico, con el objetivo de obtener su fórmula química, usando como referencia el nombre que obtiene por nomenclatura tradicional. Vamos paso a paso: Paso 1: En primer lugar, debemos conocer el nombre del compuesto y a partir del mismo, y junto a las reglas de nomenclatura, poder extraer la información necesaria: Paso 2: Escribimos las fórmulas de los reactivos, en este caso hidrógeno (recuerda que el hidrógeno se presenta en la naturaleza como moléculas diatómicas; por lo tanto se escribe: H2) y hierro (Fe), separados por un signo + (no importa el orden de los reactivos, puede escribirse el H2 o el Fe primero y luego el otro): Paso 3: Luego de los reactivos agregamos la flecha de reacción (-->) que además de indicar que se da una reacción química, separa los reactivos de los productos: Paso 4: Empezamos a platear la formula del hidruro metálico, para ello escribimos el símbolo del metal (Fe) seguido del símbolo del hidrógeno (sin separarlos con un +), después de la flecha de reacción: Paso 5: En la tabla periódica buscamos los números de oxidación de cada elemento: Paso 6: Teniendo en cuenta el nombre del compuesto seleccionamos el número de oxidación correspondiente para cada elemento: El H utilizará el -1, por ser un hidruro metálico y el Fe el +3 (mayor), ya que el nombre termina en “ico”. Paso 7: Escribimos en lápiz los valores seleccionados anteriormente en números romanos sobre cada elemento (este paso es opcional): Paso 8: Escribimos el número de oxidación del hidrógeno como subíndice del hierro y viceversa, luego borramos los números de oxidación que escribimos en lápiz: Importante: no se debe escribir 1 como subíndice debido a que el símbolo del elemento ya representa a un átomo o mol de átomos de este. Paso 9: Revisamos si la ecuación esta balanceada, para ello debemos verificar si cada elemento aparece la misma cantidad de veces en reactivos y en productos (Es importante recordar que los subíndices indican la cantidad de átomos de un elemento): Paso 10: Finalmente, si la ecuación no se encuentra balanceada, es preciso realizar esta operación. Para ello es necesario agregar coeficientes estequiométricos (éstos, son números enteros, generalmente pequeños, que se agregan frente a las fórmulas químicas de los compuestos y multiplican a cada elemento de la misma). En este caso se debe agregar un 2 delante del FeH3 en los productos y un 3 delante del H2 para que coincida la cantidad de hidrógeno, y luego se debe agregar un 2 frente al Fe en reactivos para que la cantidad de hierro coincida: Y de esta manera obtenemos la ecuación balanceada del hidruro férrico. Autor: Holzmaisters Jonathan.![]()
Para repasar lo que leíste, te proponemos que observes y tomes nota del siguiente video tutorial. Te recomendamos que a medida que avanza la explicación, pauses el video y resuelvas los ejercicios propuestos. Autor: Holzmaisters Jonathan.
____________________________________________________________________________________________________________________________________________
- Hidruros No Metálicos: Son compuestos binarios constituidos por un elemento Halógeno (F, Cl, Br, I) o Anfígeno (S, Se, Te), los cuales actúan con números de oxidación -1 y -2 respectivamente) y el hidrógeno. En estos hidruros, el no metal siempre utiliza su menor valencia negativa, mientras que el hidrógeno siempre trabaja con n° de oxidación +1. Se obtienen mediante la siguiente ecuación general:
No Metal + H2 --> Hidruro no metálico
Ejemplo: S + H2 --> H2S
Fórmula Química: Queda determinada por el no metal y el hidrógeno, cuyas valencias o números de oxidación se intercambian y se anotan como subíndices; se escribe a la izquierda el hidrógeno (por ser el más electropositivo) y el no metal a la derecha (por ser el menos electropositivo).
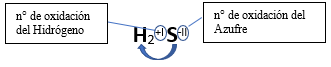
Nomenclatura:
Según la nomenclatura tradicional:
➡️ Se nombran utilizando el sufijo “uro” en el no metal y las palabras “…de hidrógeno.” Ejemplo: H2S; Sulfuro de Hidrógeno.
Ahora te proponemos que leas con atención el siguiente tutorial paso a paso para formular un Hidruro No Metálico.
Tutorial paso a paso 2: Formación de un hidruro no metálico a partir de su nombre
En este tutorial plantearemos la ecuación de formación de un hidruro no metálico, con el objetivo de obtener su fórmula química, usando como referencia el nombre que obtiene por nomenclatura tradicional.
Vamos paso a paso:
Paso 1: En primer lugar, debemos conocer el nombre del compuesto y a partir del mismo, y junto a las reglas de nomenclatura, poder extraer la información necesaria:
Paso 2: Escribimos las fórmulas de los reactivos, en este caso hidrógeno (H2) y Bromo (Br2), separados por un signo + (no importa el orden de los reactivos, puede escribirse el H2 o el Br2 primero y luego el otro):
Paso 3: Luego agregamos la flecha de reacción (-->) para separar los reactivos de los productos:
Paso 4: Empezamos a platear la fórmula del hidruro no metálico, para ello escribimos el símbolo del hidrógeno seguido del símbolo del no metal [Br] (sin separarlos con un +), después de la flecha de reacción:
Paso 5: En la tabla periódica buscamos los números de oxidación de cada elemento:
Paso 6: Teniendo en cuenta el nombre del compuesto, seleccionamos el número de oxidación correspondiente para cada elemento:
El H utilizará el +1, y el Br el -1, ya que es un hidruro no metálico (usa su menor número de oxidación negativo).
Paso 7: Escribimos en lápiz los valores seleccionados anteriormente en números romanos sobre cada elemento (este paso es opcional):
Paso 8: El número de oxidación del hidrógeno pasa como subíndice del bromo y viceversa, luego borramos los números de oxidación que escribimos en lápiz:
Importante: no se debe escribir 1 como subíndice debido a que el símbolo del elemento ya representa a un átomo o mol de átomos de este.
Paso 9: Revisamos si la ecuación esta balanceada, para ello debemos verificar si cada elemento aparece la misma cantidad de veces en reactivos y en productos:
Paso 10: Finalmente, si la ecuación no se encuentra balanceada, es preciso realizar esta operación. Para ello es necesario agregar coeficientes estequiométricos tal como se explicó en el tutorial anterior.
En este caso se debe agregar un 2 delante del HBr en productos, para que coincida la cantidad de hidrógeno y de bromo.
Y de esta manera obtenemos la ecuación balanceada del bromuro de hidrógeno
Autor: Holzmaisters Jonathan.

Para repasar lo que leíste, te proponemos que observes y tomes nota del siguiente video tutorial. Autor: Holzmaisters Jonathan.
_____________________________________________________________________________________________________________________________________________ Recordemos que los hidruros no metálicos se hallan, generalmente, en estado gaseoso a temperatura ambiente. Por otro lado, la mayoría de estos llevan a cabo múltiples funciones en disolución acuosa. Los hidrácidos, al igual que los hidruros no metálicos, son compuestos formados por Hidrógeno y un elemento no metálico que puede ser un Halógeno o un Anfígeno. La diferencia entre estos es que, un hidrácido se obtiene por la dilución en solución acuosa de un hidruro no metálico. Esto, se puede representar de la siguiente manera: Fórmula Química: Permanece igual, indicando el estado en el que se encuentra si es que éste varía. Nomenclatura: Según la nomenclatura tradicional: ➡️ En lugar de la palabra hidruro se utiliza la palabra ácido y al elemento no metálico se le agrega el sufijo “hídrico”. Ejemplo: Ácido sulfhídrico. Ahora te proponemos que leas con atención el siguiente tutorial paso a paso para formular un Hidrácido. . .Te proponemos que realices una actividad de repaso sobre las combinaciones binarias con hidrógeno. Para acceder haz CLIC AQUÍ.
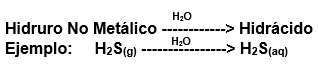
Tutorial paso a paso 3: Formación de un hidrácido a partir de su nombre
En este tutorial plantearemos la ecuación de formación de un hidrácido, con el objetivo de obtener su fórmula, usando como referencia el nombre que obtiene por nomenclatura tradicional.
Vamos paso a paso:
Paso 1: En primer lugar, debemos conocer el nombre del compuesto y a partir del mismo, y junto a las reglas de nomenclatura, poder extraer la información necesaria:
Importante: como existen 2 tipos de ácidos es necesario saber cómo diferenciarlos:
Sabemos que estamos en presencia de un oxoácido si su segundo nombre termina en ICO u OSO. Por ejemplo, Ácido Perclórico, Ácido Nítrico, Ácido Sulfuroso o Ácido Hipoyodoso.
Sabemos que estamos en presencia de un hidrácido si su segundo nombre termina en HIDRICO. Por ejemplo, Ácido Clorhídrico, Ácido Sulfhídrico o Ácido Bromhídrico.
Nota: para fines prácticos, en hidrácidos se emplea tanto la ecuación de formación como la formula general de hidruros no metálicos, lo único que cambia es la nomenclatura. Esto se debe a que los hidruros no metálicos y los hidrácidos presentan la misma fórmula química.
Recuerda que para diferenciar a los hidruros no metálicos de los hidrácidos, a estos últimos le agregamos la sigla “aq” (que significa "en solución acuosa") entre paréntesis [(aq)] luego de la formula.
Ejemplo:
Sulfuro de hidrógeno: H2S (g)
Ácido Sulfhídrico: H2S (aq)
Paso 2: Escribimos las fórmulas de los reactivos, en este caso hidrógeno (H2) y flúor (F2), separados por un signo + (no importa el orden de los reactivos, puede escribirse el H2 o el F2 primero):
Paso 3: Luego de los reactivos agregamos la flecha de reacción (-->):
Paso 4: Empezamos a platear la formula del hidrácido, para ello escribimos el símbolo del hidrógeno seguido del símbolo del no metal (F) (sin separarlos con +), después de la flecha de reacción:
Paso 5: En la tabla periódica buscamos los números de oxidación de cada elemento:
Paso 6: Teniendo en cuenta el nombre del compuesto seleccionamos el número de oxidación correspondiente para cada elemento: El H utilizará el +1, y el F el -1, ya que es un hidrácido.
Paso 7: Escribimos en lápiz los valores seleccionados anteriormente en números romanos sobre cada elemento (este paso es opcional):
Paso 8: El número de oxidación del hidrógeno pasa como subíndice del flúor y viceversa, luego borramos los números de oxidación que escribimos en lápiz:
Paso 9: Revisamos si la ecuación esta balanceada, para ello debemos verificar si cada elemento aparece la misma cantidad de veces en reactivos y en productos:
Paso 10: Finalmente, si la ecuación no se encuentra balanceada, es preciso realizar esta operación. Para ello es necesario agregar coeficientes estequiométricos. En este caso se debe agregar un 2 delante del HF en productos, para que coincida la cantidad de hidrógeno y de flúor.
Y de esta manera obtenemos la ecuación balanceada del Ácido Fluorhídrico.
Autor: Holzmaisters Jonathan.
