FUNDAMENTOS DE LA QUÍMICA
2. MATERIA Y ENERGÍA
2.6. Energía
Cuando la materia experimenta un cambio físico, como los que acabamos de mencionar, cambiará su estado, pero su identidad o composición seguirá siendo la misma. Así por ejemplo, la forma sólida del agua, como la nieve o el hielo, tienen una apariencia distinta a la de su forma líquida o gaseosa, pero las tres formas siguen siendo la misma sustancia: agua.
Anteriormente, cuando vimos los estados de la materia, introducimos la idea de que estos estados sólido, líquido y gaseoso eran función de la energía cinética o energía de movimiento de las moléculas y ahora comprenderemos por qué esto es así.
Para que una sustancia pase de un estado a otro es necesario que exista un intercambio de energía con el medio o alrededores. Este intercambio, por lo general en forma de calor, puede darse en dos sentidos: en uno, la sustancia recibe calor del medio, y en otro, la sustancia entrega calor al medio. Conforme la sustancia absorbe energía del medio, aumenta la energía cinética de las partículas. Cuando hablamos de energía cinética nos estamos refiriendo a la energía que posee la materia en virtud de su movimiento.
Cuando la sustancia absorbe energía del medio, el proceso es endotérmico. En cambio, si durante el cambio de estado se libera energía al medio, el proceso es exotérmico.
La palabra "endotérmica" deriva del griego endon que significa "dentro" y therme que significa "calor". Por eso una reacción química es endotérmica cuando absorbe energía del entorno. En este caso, la energía en forma de calor se transfiere del exterior al interior del sistema. Cuando colocamos un termómetro mientras se produce la reacción endotérmica, la temperatura disminuye.

Por ejemplo, imaginemos una compresa de agua fría que usamos para tratar distensiones musculares. Cuando las sustancias que componen la compresa (agua y una sal como nitrato de amonio, que la estudiaremos más adelante) se juntan, provocan una sensación de frío. Se trata de un proceso endotérmico en el cual se producen una absorción de energía del medio, y la característica de este tipo de reacciones es que se siente frío.
Greelane. Lo que necesita saber sobre el nitrato de amonio. [Imagen]. Recuperado de https://www.greelane.com/es/ciencia-tecnolog%c3%ada-matem%c3%a1ticas/ciencia/how-to-make-ammonium-nitrate-608267/
Por otro lado, la palabra "exotérmica" se forma por exo que significa "hacia afuera" y thermes, que significa "calor". Por eso una reacción es exotérmica cuando la energía fluye hacia afuera del sistema. En este caso la energía se libera en forma de calor, por lo que al colocar un termómetro mientras se produce la reacción, la temperatura aumenta. Las reacciones exotérmicas pueden presentarse de forma espontánea y, en algunos casos llegar a ser explosivas, como la combinación de ciertos metales y agua.
Otro ejemplo de un proceso exotérmico es la reacción de combustión que se produce cuando se usa un soplete de oxiacetileno. Este proceso también libera energía en forma de luz como lo indica la llama del soplete de la figura.
Danahé, S. J. (2015). Soldadura oxiacetilénica. [Imagen]. Recuperado de https://0grados.com.mx/soldadura-oxiacetilenica/
En la siguiente representación se muestran los cambios de estado del agua y su relación con la energía cinética. En azul se muestran los cambios exotérmicos y en rojo los endotérmicos. La energía cinética de las partículas aumenta conforme la sustancia absorbe energía del medio y disminuye a medida que la sustancia libera energía al medio.
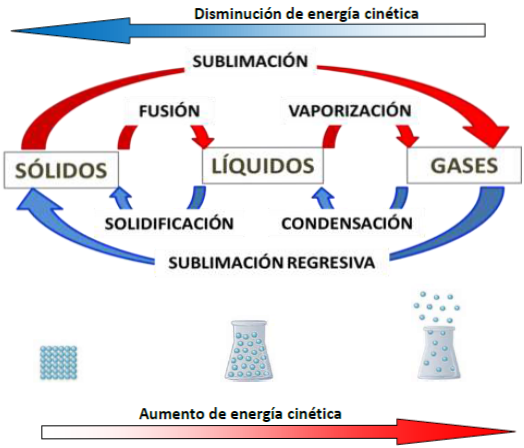
Cabanne, D., Fernández, A. (2014). Cambios de estado. [Imagen]. Cuadernillo de Nivelación en Química. Facultad de Ciencias Forestales. UNaM.
Si analizamos qué ocurre desde el punto de vista de la energía de las moléculas en los diferentes estados de la materia podemos decir que:
En el pasaje de sólido a líquido (fusión), el sólido absorbe calor y se produce un aumento de movilidad molecular. Por ejemplo, en los sólidos cristalinos como el hielo, las partículas que los forman se encuentran en posiciones fijas, como si fuera un patrón ordenado. Al absorber calor esta arquitectura molecular del sólido se desmorona haciendo que cada molécula se desplace una sobre otra pasando al estado líquido.
En el pasaje de líquido a gaseoso (vaporización), al cederle calor al líquido, aumenta su energía cinética y de esta forma se adquiere una gran movilidad molecular, que permite el pasaje del líquido al estado gaseoso.
En el pasaje de gaseoso a líquido (condensación), cuando el gas encuentra un medio más frío, con menor temperatura, cede calor, disminuye su energía cinética, se estrechan los espacios entre moléculas y de esta forma el gas pasa al estado líquido.
En el pasaje de líquido a sólido (solidificación), las moléculas del líquido que se desplazan unas sobre otras dejan de hacerlo cuando pierden calor y bajan su temperatura, disminuyendo la energía cinética a tal punto que las moléculas quedan moviéndose en su lugar y de esta manera pasan al estado sólido.
En el pasaje de sólido a gaseoso (sublimación), las moléculas al absorber calor de una fuente energética o simplemente del medio ambiente, adquieren suficiente energía cinética (movimiento) para pasar directamente al estado gaseoso.
En el pasaje de gaseoso a sólido (sublimación regresiva), ocurre una disminución importante de la temperatura que hace que las moléculas muy móviles de un gas pasen abruptamente a quedar con muy poca movilidad, moviéndose prácticamente en su lugar y pasando así al estado sólido.
Tanto el aprovechamiento de la energía liberada en algunas reacciones (exotérmicas) como el proceso inverso en el que se necesita un aporte de energía para que se produzca la reacción (endotérmica), ponen de manifiesto la importancia que tienen los intercambios energéticos en los procesos químicos y en los cambios de estado.
ACTIVIDADES PRÁCTICAS

Ahora que terminaste de leer este libro, te invitamos a que realices un cuestionario que también encontrarás en la pestaña Actividades. Ahí podrás poner en práctica todos los conceptos desarrollados hasta acá y te servirá como ejercicio y preparación para la evaluación integradora final. ¡Adelante, vamos a practicar! Haz CLIC AQUÍ.