FORMULACIÓN Y NOMENCLATURA DE COMPUESTOS INORGÁNICOS PARTE II
2. COMPUESTOS TERNARIOS: HIDRÓXIDOS Y OXOÁCIDOS
2.1. Hidróxidos
Los hidróxidos son compuestos que se producen por la combinación de un óxido básico con H2O. Se obtienen de acuerdo con la siguiente ecuación general:
Óxido Básico + H2O --> Hidróxido
Ejemplo: Al2O3 + H2O --> Al(OH)3
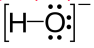
El anión hidróxido actúa como un único grupo con carga eléctrica –1, por lo que se combina con cationes de naturaleza, fundamentalmente, metálica, es decir, que tenga número de oxidación positivo.
Según la IUPAC, las agrupaciones de átomos deben ir entre paréntesis en la fórmula, aunque su uso no es obligatorio en iones de uso común, como es el caso del anión oxidrilo, salvo que al paréntesis de cierre le siga un subíndice multiplicador, en cuyo caso es siempre necesario.
Fórmula Química: La fórmula general de un hidróxido es M(OH)n, donde M es el símbolo químico del metal y n se corresponde con su número de oxidación.
Por ejemplo:
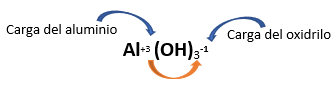
Estos compuestos también son conocidos como “bases”.
Nomenclatura: Los hidróxidos se nombran con la palabra hidróxido seguida de la preposición “de” y el nombre del metal, si este tiene 1 valencia. Ejemplo: Hidróxido de Aluminio
Si el metal tiene dos valencias, conserva el sufijo que utilizaba en el óxido básico.
➡️ “oso” cuando el elemento usa la menor valencia; Ejemplo: Fe(OH)2, valencia del hierro (II): Hidróxido ferroso.
➡️ “ico” cuando el elemento va con la mayor valencia; Ejemplo: Fe(OH)3, valencia del hierro (III): Hidróxido férrico.
Ahora te proponemos que leas con atención el siguiente tutorial paso a paso para formular un Hidróxido.
Tutorial paso a paso 1: Formación de un hidróxido a partir de su nombre
En este tutorial plantearemos la ecuación de formación de un hidróxido, con el objetivo de obtener su fórmula, usando como referencia el nombre que obtiene por nomenclatura tradicional.
Vamos paso a paso:
Paso 1: En primer lugar, debemos conocer el nombre del compuesto y a partir del mismo, y junto a las reglas de nomenclatura, poder extraer la información necesaria:
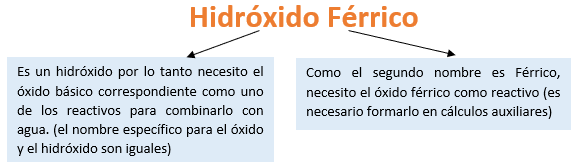
Paso 2: En cálculos auxiliares formamos el óxido férrico (puedes ayudarte con el tutorial de formación de óxidos básicos), en este caso no balancearemos la ecuación, ya que solo nos interesa la formula del óxido:
Calculo Auxiliar:
En la tabla periódica buscamos las valencias o número de oxidación del metal:

Teniendo en cuenta el nombre del compuesto seleccionamos el número de oxidación correspondiente para cada elemento:
El Fe utiliza el +3, ya que el nombre del compuesto termina en "ico", indicando que el hierro trabaja con la mayor valencia. Luego planteamos la ecuación de formación del óxido correspondiente:

Paso 3: Escribimos las fórmulas de los reactivos, en este caso el óxido férrico que formulaste en el paso anterior (Fe2O3) y agua (H2O), separados por un signo + (no importa el orden de los reactivos, puede escribirse el Fe2O3 o el H2O primero y luego el otro):

Paso 4: Luego de los reactivos agregamos la flecha de reacción (-->):

Paso 5: Empezamos a platear la formula del hidróxido, para ello escribimos después de la flecha de reacción, el símbolo del metal (Fe) seguido del grupo oxidrilo entre paréntesis, después de la flecha de reacción:

Paso 6: Escribimos el número de oxidación del Fe como subíndice del grupo oxidrilo:
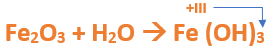
Paso 7: Revisamos si la ecuación está balanceada:
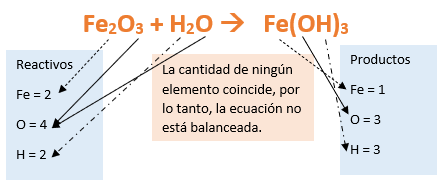
Paso 8: Finalmente, si la ecuación no se encuentra balanceada, es preciso realizar esta operación. Para ello es necesario agregar coeficientes estequiométricos. En este caso se debe agregar un 2 delante del Fe(OH)3 en productos para que coincida la cantidad de hierro y luego se debe agregar un 3 frente al H2O en reactivos para que la cantidad de oxígeno e hidrógeno coincida:
-
- Y de esta manera obtenemos la ecuación balanceada del Hidróxido Férrico.
Autor: Holzmaisters Jonathan.

Para repasar lo que leíste, te proponemos que observes y tomes nota del siguiente video tutorial. Autor: Holzmaisters Jonathan.

Los hidróxidos generalmente sirven en nuestra vida cotidiana para neutralizar los ácidos, los encontramos en una gran variedad de productos.
Los hidróxidos son importantes en la vida cotidiana, ya que es algo de uso bastante común en la fabricación de jabones combinando NaOH con grasas en un proceso denominado saponificación.
Los hidróxidos también se usan para disolver grasas, se usan en perfumería y cosmética para decolorar el cabello que se va a teñir; en la lavandería se utilizan para limpiar grasas y en farmacia es utilizado el hidróxido de aluminio -Al(OH)3- como antiácido estomacal.
Fuente: Jiménez Jaramillo, s.f. En: https://tomi.digital/es/74395/importancia-de-los-hidroxidos-en-la-vida-cotidiana?utm_source=google&utm_medium=seo

Ahora te proponemos que realices una breve actividad sobre formulación de hidróxidos. Para acceder haz CLIC AQUÍ.