PROPIEDADES Y CLASIFICACIÓN DE LA MATERIA
3. CLASIFICACIÓN DE LA MATERIA
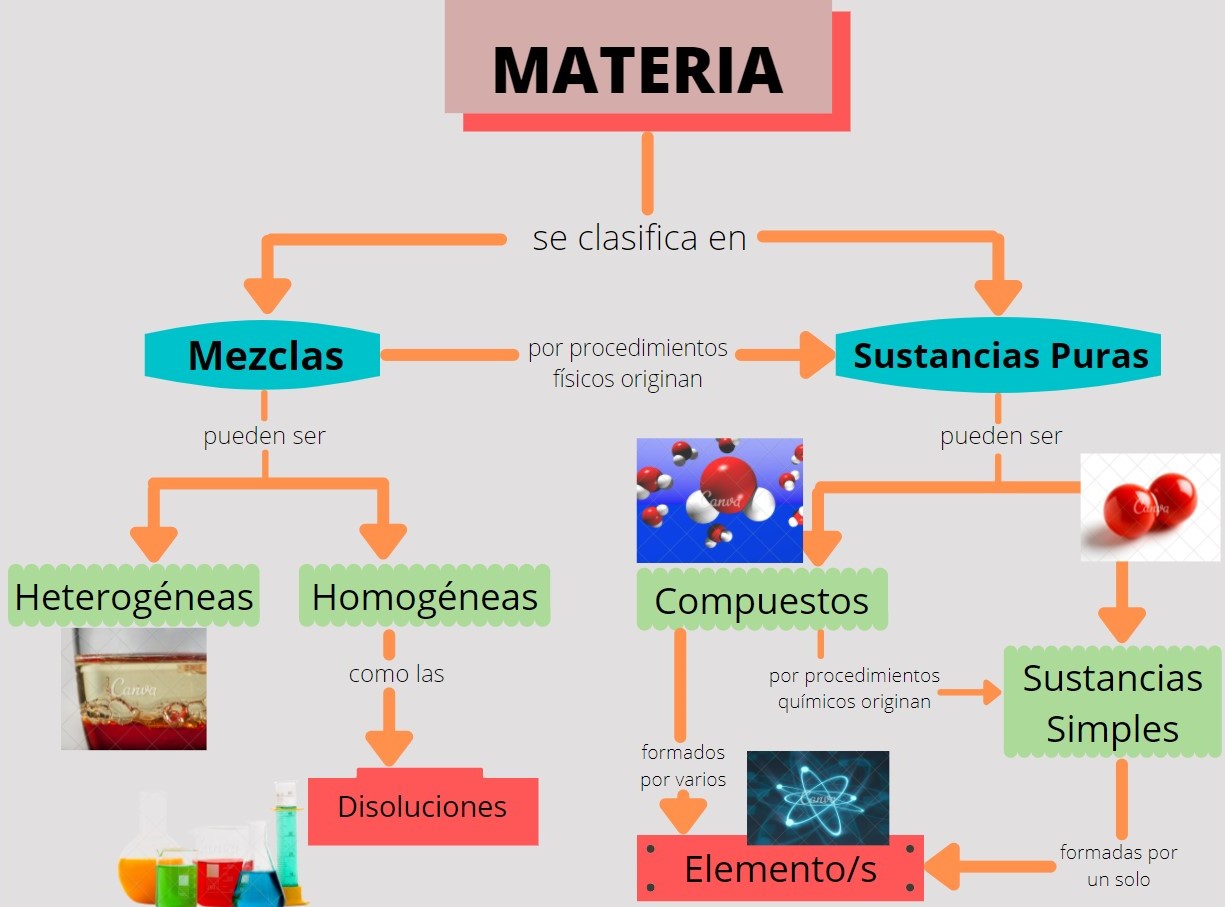
Durante todo el recorrido de los capítulos anteriores definimos, estudiamos, ejemplificamos a nuestra protagonista la materia, que incluye todo aquello que podemos ver y tocar (sol, tierra, árboles, agua) y aquello que no podemos ver ni tocar, como el aire. Como podemos ver, todo es materia, al ser tan amplia, para poder estudiarla los químicos la clasifican en varios subtipos con base en su composición y propiedades. Esta clasificación incluye sustancias, mezclas, compuestos y elementos.
Entonces comenzamos con esta clasificación de la materia, primeramente definiendo Sustancias Puras y Mezclas.
-
- Sustancias Puras: son formas de materia que tienen composición definida (constante) y propiedades que las distinguen, como vimos en el capítulo anterior cuál o cuáles son esas propiedades que pueden identificar a cada una de esas sustancias. Son ejemplos de ello el agua, sal de mesa, azúcar de mesa (sacarosa), oro y oxígeno.
Estas Sustancias Puras a su vez pueden clasificarse en elementos o compuestos:
-
- Elementos: son sustancias puras que no pueden descomponerse en otras sustancias más sencillas por medios químicos. La mayoría de estos elementos se encuentran de manera natural en la Tierra, mientras que otros de ellos se han obtenido por medios científicos mediante procesos nucleares. Algunos ejemplos de estos elementos son: oxígeno, carbono, sodio, hierro, cloro, cobre, a todos los pueden ver representados en la Tabla Periódica mediante Símbolos Químicos (tema que lo vas a estudiar mas adelante).
-
- Compuestos: Son sustancias puras constituidas por 2 o más elementos combinados en proporciones fijas. A su vez estos compuestos pueden descomponerse mediante procedimientos químicos en los elementos que los constituyen. Por ejemplo el caso del agua, de fórmula H2O, constituida por los elementos hidrógeno (H) y oxígeno (O) y se puede descomponer en ellos mediante la acción de una corriente eléctrica (electrólisis). Como pudimos ver en el ejemplo del agua los compuestos se representan mediante fórmulas químicas con los símbolos de los elementos que forman el compuesto y el número de átomos de cada uno de ellos que compone la molécula. Continuamos con el ejemplo de la fórmula del agua, la cual se forma con dos átomos del elemento hidrógeno y un átomo del elemento oxígeno formando la molécula H2O.
-
- Pero qué pasa cuando una Sustancia Pura esta formada por un solo elemento, en ese caso estamos frente a una Sustancia Simple, en las cuales las moléculas pueden estar constituidas por varios átomos pero todos son del mismo elemento, como por ejemplo el oxígeno gaseoso (O2), el ozono (O3).
-
- Mezclas: Son combinaciones de dos o más sustancias, en donde éstas sustancias conservan sus propiedades. Algunos ejemplos de la vida cotidiana pueden ser el aire, las bebidas gaseosas, la leche y el cemento. Su composición es variable, por ejemplo en el caso del aire, muestras obtenidas en distintas ciudades probablemente variarán en su composición a causa de diferencias de altitud, contaminación atmosférica y más.
Las mezclas pueden ser homogéneas o heterogéneas:
-
- Mezclas Homogéneas: también llamadas Soluciones o Disoluciones. En este tipo de mezclas no se pueden distinguir sus componentes a simple vista, su composición es uniforme, mezclas formadas por una sola fase (químicamente se denomina "fase" a una porción de materia con composición y propiedades uniformes), por ejemplo cuando se disuelve una cucharada de azúcar en agua, el aire, una aleación de oro y cobre.
- Mezclas Heterogéneas: a diferencia de las anteriores en estas mezclas si se pueden distinguir sus componentes a simple vista, por lo que su composición no es uniforme. Las mezclas heterogéneas están formadas por dos o más fases. Por ejemplo: agua y aceite, granito, arena en agua.
Cualquiera de estas mezclas se puede formar y después separar por medios físicos en sus componentes puros sin modificar la identidad de dichas sustancias, por ejemplo en el caso del azúcar en agua, al calentar esta última y evaporarla por completo podemos recuperar el azúcar. Otro ejemplo es cuando tengo una mezcla de hierro y arena, un método de separación sería a través de un imán para separar el hierro y podríamos seguir y seguir.

Si te interesa, tenés curiosidad y querés saber mas sobre Métodos de Separación de mezclas, te invitamos a ver el siguiente video:
ACTIVIDADES PRÁCTICAS
Ahora que terminaste de leer este libro, te invitamos a que realices un cuestionario que encontrarás en la pestaña Actividades 2. Ahí podrás poner en práctica todos los conceptos desarrollados hasta acá y te servirá como ejercicio y preparación para la evaluación integradora final. ¡Adelante, vamos a practicar! Haz CLIC AQUÍ.