PROPIEDADES Y CLASIFICACIÓN DE LA MATERIA
| Sitio: | Educación a Distancia - UNaM |
| Curso: | Química |
| Libro: | PROPIEDADES Y CLASIFICACIÓN DE LA MATERIA |
| Imprimido por: | Cuenta visitante |
| Día: | sábado, 7 de junio de 2025, 17:41 |
Descripción
1. INTRODUCCIÓN
En este libro vas a encontrar...

A través del Libro anterior fuimos descubriendo y estudiando poco a poco que “todo es Química”. Que como ciencia, la Química estudia las propiedades y cambios de la materia. Que todo lo que vemos a nuestro alrededor y aun nosotros mismos, está compuesto de materia. Y que esa materia se puede definir como todo aquello que ocupa un lugar en el espacio y que posee masa. Esa masa que define e identifica a la materia es una propiedad de la misma, tema que vamos a abarcar y desarrollar durante este libro, así como también su clasificación.
Te invitamos entonces a seguir avanzando en este mundo tan amplio y maravilloso de la Química junto a nosotros. En este caso a identificar y diferenciar todos los tipos de materia con los cuales convivimos y nos rodean.
Al finalizar te proponemos una serie de actividades para afianzar esos nuevos conceptos que vamos a estudiar durante este libro.
2. PROPIEDADES DE LA MATERIA
En los últimos tiempos, una de las problemáticas ambientales que más preocupa a las sociedades del mundo es el calentamiento global y el cambio climático que éste está generando. Sabemos que uno de los factores que incrementan la concentración de los gases de Efecto Invernadero en la atmósfera es la quema de combustibles fósiles, lo que ha generado un incremento en la cantidad de energía que es retenida en la atmósfera y un aumento gradual en la temperatura media mundial de la Tierra. En este sentido, los científicos trabajan para dar respuesta a esta problemática, buscando alternativas de combustibles que generen el mínimo posible de emisiones y sean más amigables con el ambiente. Es así como surge la idea del "Hidrógeno verde" y su potencial uso en reemplazo a los combustibles derivados del petróleo, carbón y gas natural.
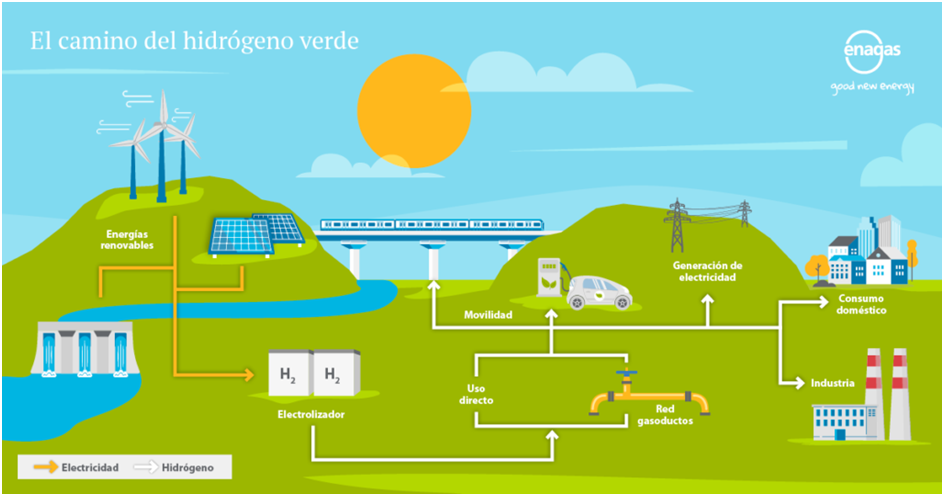
Antes de dar respuesta a estos interrogantes, los invitamos, si tienen ganas de investigar un poco, a realizar la lectura del artículo "Qué es el hidrógeno verde y cómo podría ayudar a limpiar nuestras carreteras de CO2 y a cocinar con menos humo". Para acceder al artículo debes hacer clic aquí https://www.bbc.com/mundo/noticias-50974930
En el artículo anterior, se hace referencia al Hidrógeno como un elemento capaz de reemplazar a los combustibles fósiles debido a que cuando se quema solo deja tras de sí vapor de agua, en lugar de los gases de efecto invernadero. Esta característica del hidrógeno es la razón principal por la cual los científicos eligieron a este elemento, y no a otro, para reemplazar a los combustibles fósiles. Ésta es tan solo una de las "propiedades" del hidrógeno.
Probablemente le dirías tu estatura, el color de tus ojos y de tu cabello, cuánto pesas, y algunos aspectos que hacen a tu carácter. Esas características que utilizaste para describirte son algunas de las propiedades de una persona.
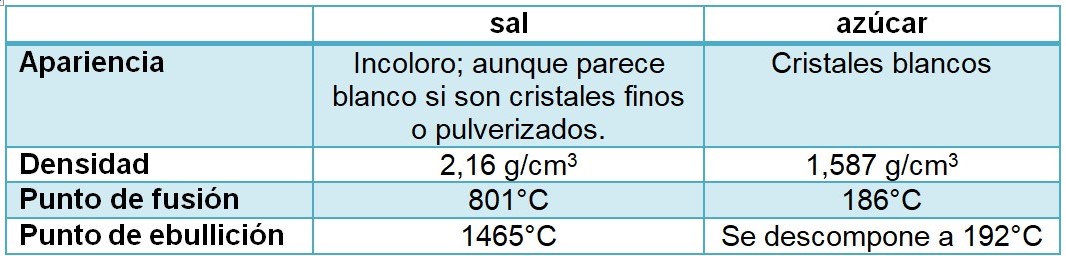
Seguramente, todos pueden reconocer algunas propiedades de la sal común de mesa, por ejemplo que es blanca al ser cristales finos o pulverizados y su uso básico es para dar sabor a las comidas. Sin embargo, ¿son suficientes estas características para diferenciar a la sal de alguna otra sustancia?
Para ayudarte a pensar te proponemos la siguiente situación:
Es un día de mucho frío y quieres prepararte un rico café con leche. Encuentras sobre la mesa dos recipientes iguales con una sustancia cristalina blanca.


A pesar de que ambos recipientes contienen sustancias que en apariencia son cristales blancos, estas dos propiedades no son suficientes para diferenciar a cada sustancia y responder a los interrogantes planteados.
¿Cómo saber qué contiene cada recipiente? Para poder caracterizar a cada sustancia y diferenciarlas, necesitamos un conjunto de propiedades, que son únicas para cada sustancia. El recipiente 1 contiene sal y el recipiente 2 contiene una sustancia con propiedades muy diferentes, azúcar. Una de esas propiedades que las diferencian indiscutiblemente es el sabor (más adelante vamos a estudiar qué es una de las propiedades de la materia), que lo podemos percibir a través del gusto. Otra en cambio que no las diferencian es que las dos son solubles en agua. En el siguiente cuadro puedes observar otras propiedades que distinguen a cada una de estas sustancias:
2.1. Propiedades Físicas y Químicas
Las propiedades de las sustancias se clasifican de manera general en propiedades químicas y físicas:
 Propiedades químicas: son las propiedades exhibidas por la materia cuando sufre cambios en su composición, es decir, que están relacionadas a los cambios químicos. Así, describen la forma en que una sustancia puede cambiar o reaccionar para formar otras sustancias diferentes. Por ejemplo, una propiedad química común es la inflamabilidad, la capacidad de una sustancia para arder en presencia de oxígeno.
Propiedades químicas: son las propiedades exhibidas por la materia cuando sufre cambios en su composición, es decir, que están relacionadas a los cambios químicos. Así, describen la forma en que una sustancia puede cambiar o reaccionar para formar otras sustancias diferentes. Por ejemplo, una propiedad química común es la inflamabilidad, la capacidad de una sustancia para arder en presencia de oxígeno.
Propiedades físic as: son aquellas propiedades que pueden ser medidas y observadas sin que cambie la composición o identidad de la materia. Estas propiedades incluyen color, olor, densidad, punto de fusión, punto de ebullición y dureza.
as: son aquellas propiedades que pueden ser medidas y observadas sin que cambie la composición o identidad de la materia. Estas propiedades incluyen color, olor, densidad, punto de fusión, punto de ebullición y dureza.
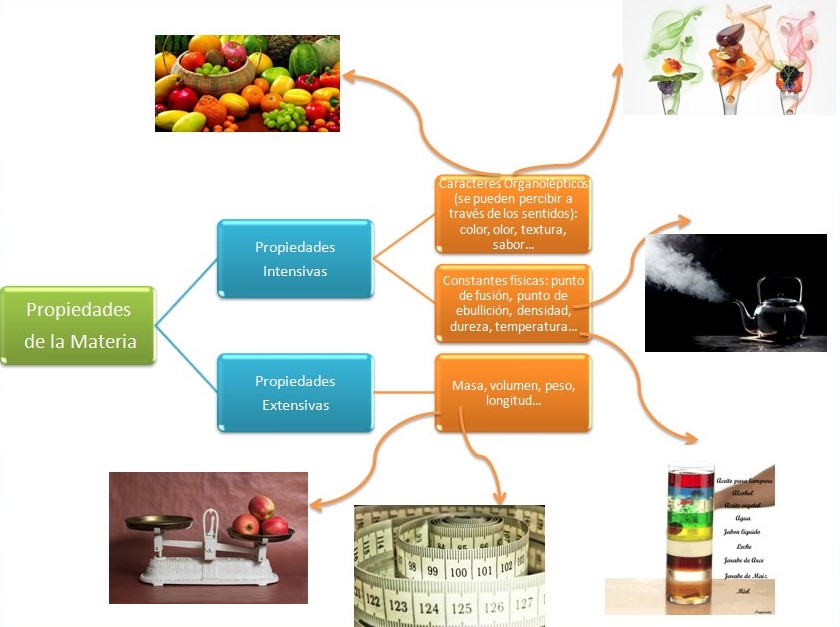
2.2. Propiedades Intensivas y Extensivas
Todas las propiedades medibles de la materia se pueden clasificar según dependan o no de la cantidad de sustancia que se esta considerando. Veamos el siguiente ejemplo:
Cuando vamos a la carnicería y le pedimos al carnicero 1 Kg de carne, el carnicero deberá pesar en la balanza una masa igual a 1000 g. Sabemos que no será lo mismo si pesa 980 g, ya que en este caso estará pesando menos cantidad de materia. Sin embargo, el color de la carne será igual ya sea que se pesen 1000 g o una cantidad menor de materia.
La masa es una propiedad extensiva ya que depende de la cantidad de materia. Otros ejemplos de propiedades extensivas son el volumen y la longitud. En cambio el color es una propiedad intensiva, no depende de la cantidad de materia. Lo son también el punto de ebullición y fusión de una sustancia, la dureza, la temperatura, la densidad, entre otras.
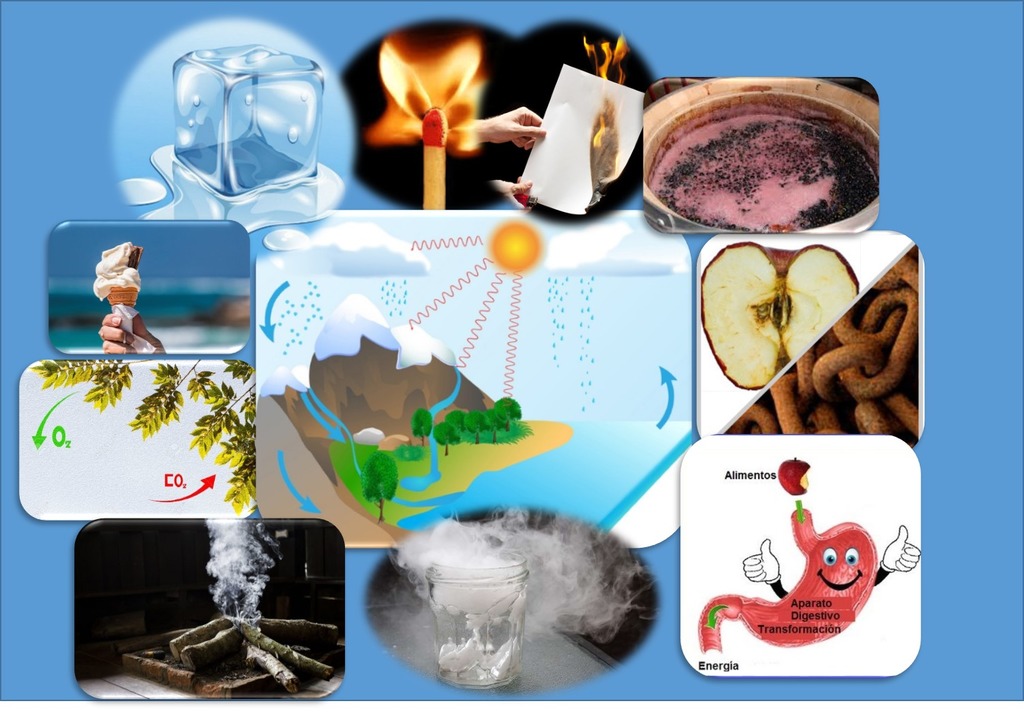
2.3. Cambios Físicos y Químicos
Vivimos rodeados de continuos cambios, tanto físicos como químicos. Esos innumerables cambios se producen tanto a nuestro alrededor como en nosotros mismos.
Los seres humanos somos animales de costumbre, día a día realizamos la mayoría de nuestras actividades de manera rutinaria, sin prestar atención en los detalles, por ejemplo, al levantarnos, cuando calentamos el agua para el mate, observar como de la pava sale vapor de agua. El pan que acompaña nuestro desayuno está hoy más esponjoso que otras veces, quizás haya sido por la cantidad de levadura que se utilizó o por haberlo horneado unos pocos minutos más. Durante nuestros estudios o trabajos utilizamos dispositivos con baterías que necesitan ser cargadas de energía para su funcionamiento, rompemos un papel en pequeños trozos para luego tirarlo a la basura. De vuelta en casa encendemos el horno de nuestra cocina para poder asar un poco de carne. Podríamos seguir y seguir citando ejemplos de cambios que suceden en cualquier momento de nuestras vidas.
-
- Cambios Físicos:
Se consideran cambios físicos a aquellos procesos que alteran las propiedades físicas de una sustancia pero no cambia su composición, es decir, no varía la naturaleza de las sustancias que intervienen. Consideremos los siguientes ejemplos: cortar un trozo de queso, disolver un poco de sal en la comida o deformar una esponja. Evaporar agua, congelar un líquido, romper un cristal.
Cuando sacamos un trozo de hielo del congelador, podríamos observar que a medida que pasa el tiempo se vuelve líquido. Si luego a ese líquido le brindamos calor a través de la hornalla de la cocina, cuando llegue a la temperatura suficiente, si prestamos atención comienza a ebullir y, al final, no quedará nada en el recipiente. Durante todo este proceso el agua únicamente sufrió cambio de estado, de sólido a líquido y de líquido a vapor de agua, pero continúa siendo agua, es decir, no sufre ninguna transformación, no cambia la sustancia. Todos los cambios de estado de las diferentes sustancias también son ejemplos de cambios físicos.
-
- Cambios Químicos:
Cuando hablamos de cambios químicos, las sustancias que intervienen se transforman en otras diferentes, con naturaleza y propiedades distintas; se forman nuevas sustancias y desaparecen las que habían al principio. Veamos algunos ejemplos de cambios químicos:
Combustión: Cuando quemamos papel o madera, estos objetos se combinan con el oxígeno existente en la atmósfera inicialmente y pasamos a tener cenizas, dióxido de carbono y vapor de agua.
Oxidación: Cuando el hierro se oxida se produce una transformación del metal en herrumbre, es decir, “desaparece el hierro” y “aparece el óxido”.
Así como también otros objetos que nos rodean son producto de procesos en los que hay cambios químicos: combustibles, plásticos, fármacos, elaboración de jabones, fermentación de alimentos etc.
https://quizlet.com/mx/317408703/cambios-físicos-y-químicos-de-la-materia-diagram/
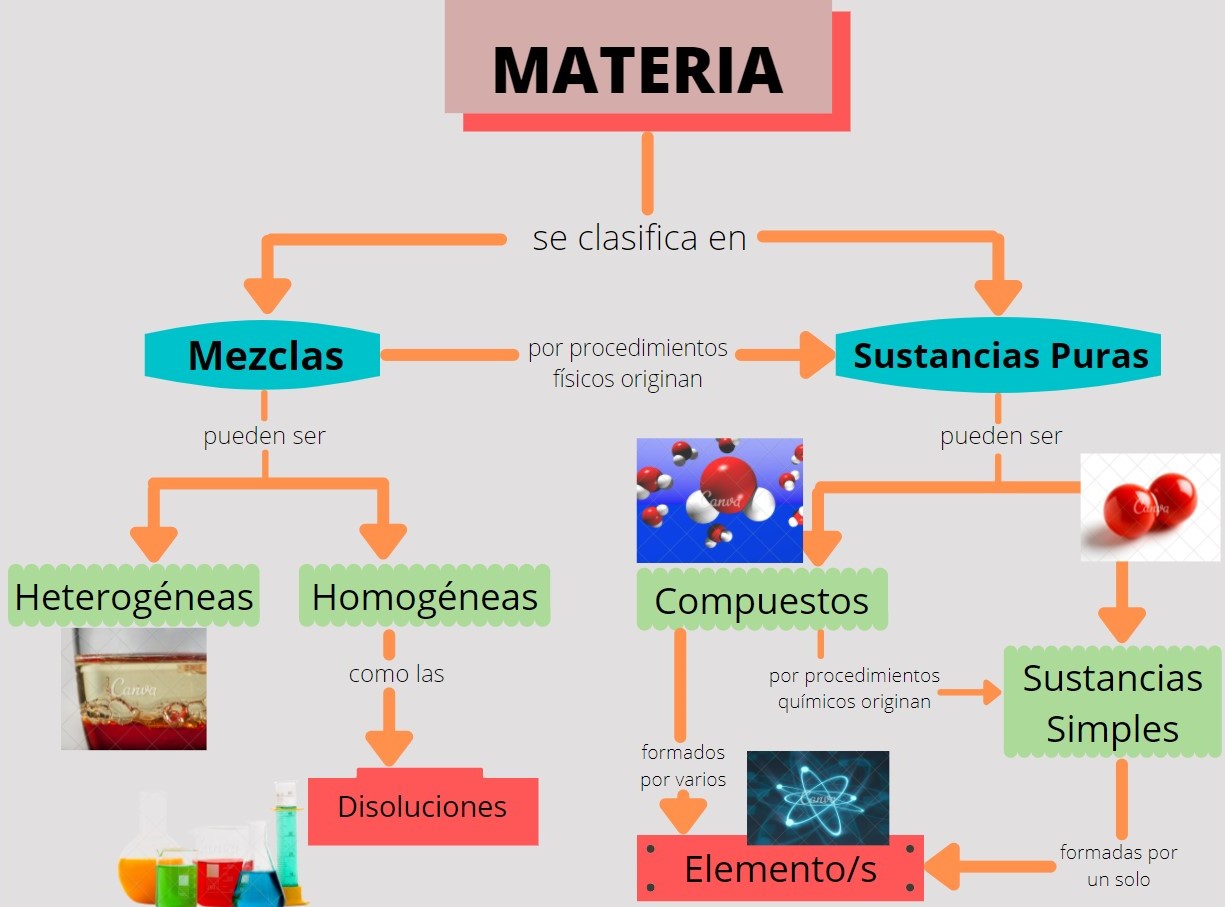
3. CLASIFICACIÓN DE LA MATERIA
Durante todo el recorrido de los capítulos anteriores definimos, estudiamos, ejemplificamos a nuestra protagonista la materia, que incluye todo aquello que podemos ver y tocar (sol, tierra, árboles, agua) y aquello que no podemos ver ni tocar, como el aire. Como podemos ver, todo es materia, al ser tan amplia, para poder estudiarla los químicos la clasifican en varios subtipos con base en su composición y propiedades. Esta clasificación incluye sustancias, mezclas, compuestos y elementos.
Entonces comenzamos con esta clasificación de la materia, primeramente definiendo Sustancias Puras y Mezclas.
-
- Sustancias Puras: son formas de materia que tienen composición definida (constante) y propiedades que las distinguen, como vimos en el capítulo anterior cuál o cuáles son esas propiedades que pueden identificar a cada una de esas sustancias. Son ejemplos de ello el agua, sal de mesa, azúcar de mesa (sacarosa), oro y oxígeno.
Estas Sustancias Puras a su vez pueden clasificarse en elementos o compuestos:
-
- Elementos: son sustancias puras que no pueden descomponerse en otras sustancias más sencillas por medios químicos. La mayoría de estos elementos se encuentran de manera natural en la Tierra, mientras que otros de ellos se han obtenido por medios científicos mediante procesos nucleares. Algunos ejemplos de estos elementos son: oxígeno, carbono, sodio, hierro, cloro, cobre, a todos los pueden ver representados en la Tabla Periódica mediante Símbolos Químicos (tema que lo vas a estudiar mas adelante).
-
- Compuestos: Son sustancias puras constituidas por 2 o más elementos combinados en proporciones fijas. A su vez estos compuestos pueden descomponerse mediante procedimientos químicos en los elementos que los constituyen. Por ejemplo el caso del agua, de fórmula H2O, constituida por los elementos hidrógeno (H) y oxígeno (O) y se puede descomponer en ellos mediante la acción de una corriente eléctrica (electrólisis). Como pudimos ver en el ejemplo del agua los compuestos se representan mediante fórmulas químicas con los símbolos de los elementos que forman el compuesto y el número de átomos de cada uno de ellos que compone la molécula. Continuamos con el ejemplo de la fórmula del agua, la cual se forma con dos átomos del elemento hidrógeno y un átomo del elemento oxígeno formando la molécula H2O.
-
- Pero qué pasa cuando una Sustancia Pura esta formada por un solo elemento, en ese caso estamos frente a una Sustancia Simple, en las cuales las moléculas pueden estar constituidas por varios átomos pero todos son del mismo elemento, como por ejemplo el oxígeno gaseoso (O2), el ozono (O3).
-
- Mezclas: Son combinaciones de dos o más sustancias, en donde éstas sustancias conservan sus propiedades. Algunos ejemplos de la vida cotidiana pueden ser el aire, las bebidas gaseosas, la leche y el cemento. Su composición es variable, por ejemplo en el caso del aire, muestras obtenidas en distintas ciudades probablemente variarán en su composición a causa de diferencias de altitud, contaminación atmosférica y más.
Las mezclas pueden ser homogéneas o heterogéneas:
-
- Mezclas Homogéneas: también llamadas Soluciones o Disoluciones. En este tipo de mezclas no se pueden distinguir sus componentes a simple vista, su composición es uniforme, mezclas formadas por una sola fase (químicamente se denomina "fase" a una porción de materia con composición y propiedades uniformes), por ejemplo cuando se disuelve una cucharada de azúcar en agua, el aire, una aleación de oro y cobre.
- Mezclas Heterogéneas: a diferencia de las anteriores en estas mezclas si se pueden distinguir sus componentes a simple vista, por lo que su composición no es uniforme. Las mezclas heterogéneas están formadas por dos o más fases. Por ejemplo: agua y aceite, granito, arena en agua.
Cualquiera de estas mezclas se puede formar y después separar por medios físicos en sus componentes puros sin modificar la identidad de dichas sustancias, por ejemplo en el caso del azúcar en agua, al calentar esta última y evaporarla por completo podemos recuperar el azúcar. Otro ejemplo es cuando tengo una mezcla de hierro y arena, un método de separación sería a través de un imán para separar el hierro y podríamos seguir y seguir.

Si te interesa, tenés curiosidad y querés saber mas sobre Métodos de Separación de mezclas, te invitamos a ver el siguiente video:
ACTIVIDADES PRÁCTICAS
Ahora que terminaste de leer este libro, te invitamos a que realices un cuestionario que encontrarás en la pestaña Actividades 2. Ahí podrás poner en práctica todos los conceptos desarrollados hasta acá y te servirá como ejercicio y preparación para la evaluación integradora final. ¡Adelante, vamos a practicar! Haz CLIC AQUÍ.
4. REFERENCIAS
-
- Bibliográficas:
Brown, T. L., LeMay, H. E., Bursten, B. E., & Burdge, J. R. (2004). Química. La ciencia central (9° ed.). México: Pearson Educación.
Chang, R., College, W. (2010). "Química, décima edición". McGraw-Hill Interamericana Editores S.A.
-
- Páginas, imágenes y tablas:
http://cenalista.blogspot.com/2013/12/caracteristicas-organolepticas.html
https://octaviopazamazcala.blogspot.com/2021/02/ciencias-ii-fisica-2abcd-semana-22.html
https://tomi.digital/es/22584/clasificacion-de-la-materia?utm_source=google&utm_medium=seo
https://www.diferenciador.com/propiedades-intensivas-y-extensivas/
https://www.ejemplos.co/30-ejemplos-de-ebullicion/
https://www.significados.com/propiedades-intensivas-y-extensivas-de-la-materia/
