FORMULACIÓN Y NOMENCLATURA DE COMPUESTOS INORGÁNICOS PARTE I
2. CONCEPTOS BÁSICOS
2.5. Ecuaciones Químicas
Las sustancias químicas se forman a través de reacciones químicas y éstas se representan mediante ecuaciones químicas. En una ecuación química se observan las sustancias que reaccionan (reactivos) y las sustancias que se obtienen (productos). Además, se indican las cantidades relativas de las sustancias involucradas y sus estados de agregación (Cabanne y Fernández, 2014). Ver Imagen 1.
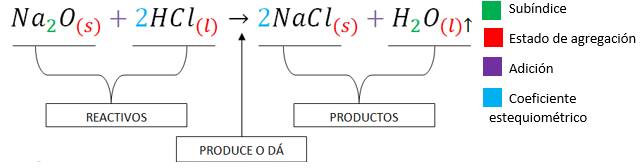
Imagen 1. Extraída de: Cabanne, Daniela; Fernández, Andrea. (2014). "Capítulo III: Formulación de compuestos inorgánicos. Nomenclatura". Cuadernillo de Nivelación en Química. Facultad de Ciencias Forestales. UNaM.
Ejemplo: Cuando el hidrógeno arde, reacciona con el oxígeno del aire para producir agua. Esta reacción se puede representar de la siguiente manera:
H2 + O2 --> H2O
Importante: Los elementos que, en la tabla periódica pueden identificarse como gases (H, N, O, F, Cl), en su estado natural se encuentran como moléculas diatómicas, es decir, que están formadas por dos átomos del elemento. Por lo tanto, cuando escribimos a alguno de estos elementos en las ecuaciones de formación colocamos, debajo del símbolo del elemento, como subíndice un “2”. Ejemplo: H2.
Para balancear esta ecuación debemos tener en cuenta la cantidad de átomos de cada elemento que tenemos a cada lado de la reacción. Si la observamos, podemos notar que, tanto el oxígeno como el hidrógeno son elementos diatómicos, por lo tanto, del lado de los reactivos tenemos 2 átomos de Hidrógeno (H2) y 2 átomos de Oxígeno (O2). Mientras que, del lado de los productos tenemos 2 átomos de Hidrógeno y 1 átomo de Oxígeno.
Para igualar las cantidades de átomos, utilizamos coeficientes estequiométricos, los cuales se ubican delante de la fórmula química de los reactivos y/o de los productos según sea el caso. Cuando el coeficiente es igual a 1, no se escribe.
Para nuestro ejemplo:
H2 + O2 --> H2O
Como tenemos 2 átomos de Oxígeno del lado de los reactivos y sólo 1 en el producto, colocamos como coeficiente estequiométrico el número 2, delante de la fórmula química del producto:
H2 + O2 --> 2 H2O
El coeficiente estequiométrico multiplica la cantidad de átomos que tenemos de cada elemento en esa molécula. Es decir, como teníamos…
1 átomo de Oxígeno = 1 Oxígeno x 2= 2 Oxígeno
2 átomos de Hidrógeno = 2 Hidrógeno x 1= 2 Hidrógeno
Por lo tanto, ahora tenemos 2 átomos de Hidrógeno y 2 átomos de Oxígeno en los reactivos, mientras que en los productos tenemos 4 átomos de Hidrógeno y 2 de Oxígeno.
Posteriormente, colocamos un coeficiente estequiométrico de valor 2 delante del Hidrógeno que se halla en el lado de los reactivos:
2 H2 + O2 --> 2 H2O
.

.Te proponemos que realices una actividad en la que podrás repasar y aplicar los conceptos desarrollados. Para acceder haz CLIC AQUÍ.