FORMULACIÓN Y NOMENCLATURA DE COMPUESTOS INORGÁNICOS PARTE I
2. CONCEPTOS BÁSICOS
2.5. Ecuaciones Químicas
Las sustancias químicas se forman a través de reacciones químicas y éstas se representan mediante ecuaciones químicas. En una ecuación química se observan las sustancias que reaccionan (reactivos) y las sustancias que se obtienen (productos). Además, se indican las cantidades relativas de las sustancias involucradas y sus estados de agregación (Cabanne y Fernández, 2014). Ver Imagen 1.
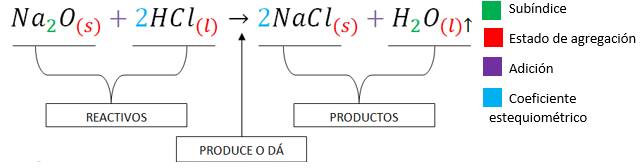
Imagen 1. Extraída de: Cabanne, Daniela; Fernández, Andrea. (2014). "Capítulo III: Formulación de compuestos inorgánicos. Nomenclatura". Cuadernillo de Nivelación en Química. Facultad de Ciencias Forestales. UNaM.
Ejemplo: Cuando el hidrógeno arde, reacciona con el oxígeno del aire para producir agua. Esta reacción se puede representar de la siguiente manera:
H2 + O2 --> H2O
Para balancear esta ecuación debemos tener en cuenta la cantidad de átomos de cada elemento que tenemos a cada lado de la reacción. Si la observamos, podemos notar que, tanto el oxígeno como el hidrógeno son elementos diatómicos, por lo tanto, del lado de los reactivos tenemos 2 átomos de Hidrógeno (H2) y 2 átomos de Oxígeno (O2). Mientras que, del lado de los productos tenemos 2 átomos de Hidrógeno y 1 átomo de Oxígeno.
Para igualar las cantidades de átomos, utilizamos coeficientes estequiométricos, los cuales se ubican delante de la fórmula química de los reactivos y/o de los productos según sea el caso. Cuando el coeficiente es igual a 1, no se escribe.
Para nuestro ejemplo:
H2 + O2 --> H2O
Como tenemos 2 átomos de Oxígeno del lado de los reactivos y sólo 1 en el producto, colocamos como coeficiente estequiométrico el número 2, delante de la fórmula química del producto:
H2 + O2 --> 2 H2O
El coeficiente estequiométrico multiplica la cantidad de átomos que tenemos de cada elemento en esa molécula. Es decir, como teníamos…
1 átomo de Oxígeno = 1 Oxígeno x 2= 2 Oxígeno
2 átomos de Hidrógeno = 2 Hidrógeno x 1= 2 Hidrógeno
Por lo tanto, ahora tenemos 2 átomos de Hidrógeno y 2 átomos de Oxígeno en los reactivos, mientras que en los productos tenemos 4 átomos de Hidrógeno y 2 de Oxígeno.
Posteriormente, colocamos un coeficiente estequiométrico de valor 2 delante del Hidrógeno que se halla en el lado de los reactivos:
2 H2 + O2 --> 2 H2O
.

.Te proponemos que realices una actividad en la que podrás repasar y aplicar los conceptos desarrollados. Para acceder haz CLIC AQUÍ.